

Вторичная структура нуклеиновой кислоты представляет собой взаимодействие спаривания оснований внутри одного полимера нуклеиновой кислоты или между двумя полимерами. Его можно представить в виде списка оснований, спаренных в молекуле нуклеиновой кислоты. [1]
Вторичные структуры биологических ДНК и РНК , как правило, различаются: биологическая ДНК в основном существует в виде двойных спиралей, полностью спаренных основаниями , в то время как биологическая РНК является одноцепочечной и часто образует сложные и замысловатые взаимодействия спаривания оснований из-за своей повышенной способности образовывать водородные связи , возникающие из-за дополнительной гидроксильной группы в сахаре рибозе . [ нужна цитата ]
В небиологическом контексте вторичная структура является жизненно важным фактором при проектировании структур нуклеиновых кислот для нанотехнологий ДНК и вычислений ДНК , поскольку характер спаривания оснований в конечном итоге определяет общую структуру молекул.
В молекулярной биологии два нуклеотида на противоположных комплементарных цепях ДНК или РНК , соединенных водородными связями , называются парой оснований (часто сокращенно bp). В канонической паре оснований Уотсона-Крика аденин (А) образует пару оснований с тимином (Т), а гуанин (G) образует пару оснований с цитозином (С) в ДНК. В РНК тимин заменен урацилом (U). Также встречаются альтернативные модели водородных связей, такие как колебательная пара оснований и пара оснований Хугстина , особенно в РНК, что приводит к образованию сложных и функциональных третичных структур . Важно отметить, что спаривание — это механизм, с помощью которого кодоны молекул информационной РНК распознаются антикодонами транспортной РНК во время трансляции белка . Некоторые ДНК- или РНК-связывающие ферменты могут распознавать определенные закономерности спаривания оснований, которые идентифицируют определенные регуляторные области генов. Водородная связь — это химический механизм, лежащий в основе описанных выше правил спаривания оснований. Соответствующее геометрическое соответствие доноров и акцепторов водородных связей позволяет стабильно образовывать только «правильные» пары. ДНК с высоким содержанием GC более стабильна, чем ДНК с низким содержанием GC , но вопреки распространенному мнению, водородные связи не стабилизируют ДНК существенно, и стабилизация происходит главным образом за счет стекинговых взаимодействий. [2]
Более крупные нуклеиновые основания , аденин и гуанин, являются членами класса химических структур с двойным кольцом, называемых пуринами ; меньшие азотистые основания, цитозин и тимин (и урацил), являются членами класса однокольцевых химических структур, называемых пиримидинами . Пурины дополняют только пиримидины: пары пиримидин-пиримидин энергетически невыгодны, поскольку молекулы расположены слишком далеко друг от друга для установления водородных связей; пурин-пуриновые пары энергетически невыгодны, поскольку молекулы расположены слишком близко, что приводит к перекрывающемуся отталкиванию. Единственные возможные пары — GT и AC; эти пары не совпадают, поскольку структура доноров и акцепторов водорода не соответствует. Пара оснований GU с двумя водородными связями довольно часто встречается в РНК .
Гибридизация – это процесс связывания комплементарных пар оснований с образованием двойной спирали . Плавление — это процесс, при котором взаимодействия между нитями двойной спирали разрываются, разделяя две цепи нуклеиновой кислоты. Эти связи слабы, их легко разделить при слабом нагревании, ферментах или физической силе. Плавление происходит преимущественно в определенных точках нуклеиновой кислоты. [3] Последовательности, богатые T и A , легче плавятся, чем области, богатые C и G. Определенные этапы основания также подвержены плавлению ДНК, особенно этапы основания TA и TG . [4] Эти механические особенности отражены в использовании таких последовательностей, как TATAA, в начале многих генов, которые помогают РНК-полимеразе плавить ДНК для транскрипции.
Разделение цепей при осторожном нагревании, которое используется в ПЦР , является простым, если молекулы имеют менее примерно 10 000 пар оснований (10 тысяч пар оснований, или 10 т.п.н.). Переплетение нитей ДНК затрудняет разделение длинных сегментов. Клетка избегает этой проблемы, позволяя своим ферментам плавления ДНК ( геликазам ) работать одновременно с топоизомеразами , которые могут химически расщеплять фосфатный остов одной из цепей, чтобы она могла вращаться вокруг другой. Хеликазы раскручивают нити, чтобы облегчить продвижение ферментов, считывающих последовательность, таких как ДНК-полимераза .

Вторичная структура нуклеиновой кислоты обычно делится на спирали (соседние пары оснований) и различные виды петель (неспаренные нуклеотиды, окруженные спиралями). Часто эти элементы или их комбинации далее классифицируются в дополнительные категории, включая, например, тетрапетли , псевдоузлы и петли-стебли . Топологические подходы можно использовать для классификации и сравнения сложных структур, возникающих в результате объединения этих элементов в различных расположениях.
Двойная спираль представляет собой важную третичную структуру молекул нуклеиновой кислоты, которая тесно связана с вторичной структурой молекулы. Двойная спираль образована участками множества последовательных пар оснований.
Двойная спираль нуклеиновой кислоты представляет собой спиральный полимер, обычно правосторонний, содержащий две нуклеотидные цепи, образующие пары оснований . Один виток спирали составляет около десяти нуклеотидов и содержит большую бороздку и малую бороздку, причем большая бороздка шире малой. [5] Учитывая разницу в ширине большой и малой бороздки, многие белки, которые связываются с ДНК, делают это через более широкую большую бороздку. [6] Возможны многие двуспиральные формы; для ДНК тремя биологически значимыми формами являются A-ДНК , B-ДНК и Z-ДНК , тогда как двойные спирали РНК имеют структуру, аналогичную форме А ДНК.

Вторичная структура молекул нуклеиновых кислот часто может быть однозначно разложена на стебли и петли. Структура «стебель-петля» (также часто называемая «шпилькой»), в которой спираль с парными основаниями заканчивается короткой непарной петлей, чрезвычайно распространена и является строительным блоком для более крупных структурных мотивов, таких как структуры клеверного листа, которые четырехспиральные соединения, подобные тем, которые встречаются в транспортной РНК . Также часто встречаются внутренние петли (короткий ряд непарных оснований в более длинной парной спирали) и выпуклости (участки, в которых одна цепь спирали имеет «лишние» вставленные основания без аналогов в противоположной цепи).
Существует множество элементов вторичной структуры, имеющих функциональное значение для биологических РНК; некоторыми известными примерами являются Rho-независимые терминаторные петли стебля и тРНК клеверный лист . Продолжаются активные исследования по определению вторичной структуры молекул РНК с использованием подходов, включающих как экспериментальные , так и вычислительные методы (см. Также Список программного обеспечения для прогнозирования структуры РНК ).
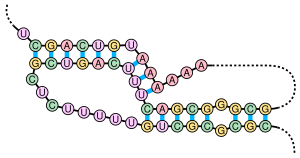
Псевдоузел представляет собой вторичную структуру нуклеиновой кислоты, содержащую по крайней мере две структуры «стебель-петля» , в которых половина одного стебля вставлена между двумя половинками другого стебля. Псевдоузлы складываются в узловые трехмерные конформации, но не являются настоящими топологическими узлами . Спаривание оснований в псевдоузлах плохо вложено; то есть встречаются пары оснований, которые «перекрывают» друг друга в положении последовательности. Это делает невозможным предсказать присутствие общих псевдоузлов в последовательностях нуклеиновых кислот с помощью стандартного метода динамического программирования , который использует рекурсивную систему оценки для идентификации парных стеблей и, следовательно, не может обнаружить невложенные пары оснований с помощью обычных алгоритмов. Однако ограниченные подклассы псевдоузлов можно предсказать с помощью модифицированных динамических программ. [8] Новые методы прогнозирования структуры, такие как стохастические контекстно-свободные грамматики, также не могут учитывать псевдоузлы.
Псевдоузлы могут образовывать различные структуры с каталитической активностью [9] , а некоторые важные биологические процессы зависят от молекул РНК, образующих псевдоузлы. Например, РНК-компонент теломеразы человека содержит псевдоузел, который имеет решающее значение для ее активности. [7] Рибозим вируса гепатита дельта является хорошо известным примером каталитической РНК с псевдоузлом в активном центре. [10] [11] Хотя ДНК также может образовывать псевдоузлы, они обычно не присутствуют в стандартных физиологических условиях .
Большинство методов предсказания вторичной структуры нуклеиновых кислот основаны на термодинамической модели ближайшего соседа. [12] [13] Распространенный метод определения наиболее вероятных структур с учетом последовательности нуклеотидов использует алгоритм динамического программирования , который стремится найти структуры с низкой свободной энергией. [14] Алгоритмы динамического программирования часто запрещают псевдоузлы или другие случаи, в которых пары оснований не полностью вложены друг в друга, поскольку рассмотрение этих структур становится очень дорогостоящим в вычислительном отношении даже для небольших молекул нуклеиновой кислоты. Другие методы, такие как стохастические контекстно-свободные грамматики, также могут использоваться для прогнозирования вторичной структуры нуклеиновой кислоты.
Для многих молекул РНК вторичная структура очень важна для правильного функционирования РНК — часто даже больше, чем фактическая последовательность. Этот факт помогает в анализе некодирующих РНК, иногда называемых «генами РНК». Одно из применений биоинформатики использует предсказанные вторичные структуры РНК для поиска в геноме некодирующих, но функциональных форм РНК. Например, микроРНК имеют канонические длинные структуры «стебель-петля», прерываемые небольшими внутренними петлями.
Вторичная структура РНК применяется при сплайсинге РНК у некоторых видов. У людей и других четвероногих было показано, что без белка U2AF2 процесс сплайсинга ингибируется. Однако у рыбок данио и других костистых рыб процесс сплайсинга РНК все еще может происходить на определенных генах в отсутствие U2AF2. Это может быть связано с тем, что 10% генов рыбок данио имеют чередующиеся пары оснований TG и AC в 3'-сайте сплайсинга (3'ss) и 5'-сайте сплайсинга (5'ss) соответственно на каждом интроне, что изменяет вторичную структуру РНК. Это предполагает, что вторичная структура РНК может влиять на сплайсинг, возможно, без использования таких белков, как U2AF2, которые, как считалось, необходимы для сплайсинга. [15]
Вторичную структуру РНК можно определить по координатам атомов (третичная структура), полученным методом рентгеновской кристаллографии , часто хранящимся в Банке данных белков . Современные методы включают 3DNA/DSSR [16] и MC-аннотацию. [17]