Посттранскрипционная регуляция — это контроль экспрессии генов на уровне РНК . Она происходит после того, как РНК-полимераза присоединяется к промотору гена и синтезирует нуклеотидную последовательность. Поэтому, как следует из названия, она происходит между фазой транскрипции и фазой трансляции экспрессии генов . Эти элементы контроля имеют решающее значение для регуляции многих генов в тканях человека. [1] [2] Она также играет большую роль в физиологии клеток, будучи вовлеченной в такие патологии, как рак и нейродегенеративные заболевания. [3]
После производства стабильность и распределение различных транскриптов регулируется (посттранскрипционная регуляция) с помощью РНК- связывающего белка (RBP), который контролирует различные этапы и скорости, контролирующие события, такие как альтернативный сплайсинг , ядерная деградация ( экзосома ), процессинг, ядерный экспорт (три альтернативных пути), секвестрация в P-телах для хранения или деградации и, в конечном итоге, трансляция . Эти белки достигают этих событий благодаря мотиву распознавания РНК (RRM), который связывает определенную последовательность или вторичную структуру транскриптов, как правило, в 5' и 3' UTR транскрипта. Короче говоря, последовательности dsRNA, которые будут разбиты на siRNA внутри организма, будут совпадать с РНК, чтобы ингибировать экспрессию гена в клетке.
Модуляция кэппинга, сплайсинга, добавления поли(А)-хвоста , специфичных для последовательности скоростей ядерного экспорта и в некоторых контекстах секвестрации транскрипта РНК происходит у эукариот , но не у прокариот . Эта модуляция является результатом белка или транскрипта, который, в свою очередь, регулируется и может иметь сродство к определенным последовательностям.
Ослабление транскрипции — это тип прокариотической регуляции, который происходит только при определенных условиях. Этот процесс происходит в начале транскрипции РНК и приводит к тому, что цепь РНК обрывается до экспрессии гена. [5] Ослабление транскрипции вызвано неправильным формированием зарождающейся цепи РНК. Эта зарождающаяся цепь РНК принимает альтернативную вторичную структуру, которая не взаимодействует должным образом с РНК-полимеразой . [1] Для продолжения экспрессии гена регуляторные белки должны связываться с цепью РНК и устранять ослабление, что дорого обходится клетке. [1] [6]
У прокариот есть два механизма ослабления транскрипции: внутренняя терминация и фактор-зависимая терминация.
- В механизме внутренней терминации , также известном как Rho-независимая терминация , цепь РНК образует стабильную структуру шпильки транскрипта на 3'-конце генов, что заставляет РНК-полимеразу прекратить транскрипцию. [6] За петлей-стеблем следует бег U (поли U-хвост), который останавливает полимеразу, поэтому у шпильки РНК есть достаточно времени для формирования. Затем полимераза диссоциирует из-за слабой связи между поли U-хвостом транскрипта РНК и поли A-хвостом матрицы ДНК, что приводит к преждевременному высвобождению мРНК. Этот процесс ингибирует транскрипцию. [7] Для ясности, этот механизм называется Rho-независимым, потому что он не требует никакого дополнительного белкового фактора, как фактор-зависимая терминация, что является более простым механизмом для клетки, чтобы регулировать транскрипцию гена. [7] Примерами бактерий, у которых преобладает этот тип регуляции, являются Neisseria, Psychrobacter и Pasteurellaceae , а также большинство бактерий типа Firmicutes. [7] [6]
- В фактор-зависимой терминации , которая представляет собой комплекс белкового фактора, содержащий Rho-фактор , связан с сегментом транскрипта цепи РНК. Затем комплекс Rho начинает искать в направлении 3' приостановленную РНК-полимеразу. Если полимераза найдена, процесс немедленно останавливается, что приводит к прерыванию транскрипции РНК. [5] [6] Несмотря на то, что эта система не так распространена, как описанная выше, есть некоторые бактерии, которые используют этот тип терминации, например, оперон tna в E.coli . [7]
Этот тип регуляции неэффективен у эукариот, поскольку транскрипция происходит в ядре, а трансляция — в цитоплазме. Поэтому механизм не продолжается и не может выполняться должным образом, как если бы оба процесса происходили в цитоплазме. [8]
МикроРНК (миРНК), по-видимому, регулируют экспрессию более 60% генов, кодирующих белки, в геноме человека. [9] Если микроРНК много, она может действовать как «переключатель», включая или выключая некоторые гены. [10] Однако измененная экспрессия многих микроРНК приводит лишь к скромному изменению экспрессии белков их целевых генов в 1,5–4 раза. [10] Отдельные микроРНК часто подавляют несколько сотен целевых генов. [9] [11] Репрессия обычно происходит либо посредством трансляционного подавления мРНК, либо посредством деградации мРНК посредством комплементарного связывания, в основном со специфическими последовательностями в 3'-нетранслируемой области мРНК целевого гена. [12] Механизм трансляционного подавления или деградации мРНК реализуется через комплекс РНК-индуцированного подавления (RISC).
РНК-связывающие белки (RBP) представляют собой динамические сборки между мРНК и различными белками, которые образуют комплексы рибонуклеопротеинов-мессенджеров (мРНП). [13] Эти комплексы необходимы для регуляции экспрессии генов, чтобы гарантировать, что все этапы выполняются правильно на протяжении всего процесса. Поэтому они являются важными факторами контроля уровней белков и фенотипов клеток. Более того, они влияют на стабильность мРНК, регулируя ее конформацию из-за окружающей среды, стресса или внеклеточных сигналов. [13] Однако их способность связывать и контролировать такое большое разнообразие РНК-мишеней позволяет им формировать сложные регуляторные сети (PTRN). Эти сети представляют собой проблему для изучения каждого РНК-связывающего белка по отдельности. [3] К счастью, благодаря новым методологическим достижениям идентификация RBP медленно расширяется, что демонстрирует, что они содержатся в широких семействах белков. RBP могут существенно влиять на множество биологических процессов и должны быть очень точно выражены. [7] Сверхэкспрессия может изменить скорость целевой мРНК, связываясь с низкоаффинными участками РНК и вызывая пагубные результаты для клеточной приспособленности. Неспособность синтезировать на правильном уровне также является проблемой, поскольку это может привести к гибели клетки. Таким образом, RBP регулируются посредством ауторегуляции , поэтому они контролируют свои собственные действия. Кроме того, они используют как отрицательную обратную связь , чтобы поддерживать гомеостаз, так и положительную обратную связь , чтобы создавать бинарные генетические изменения в клетке. [14]
У метазоа и бактерий многие гены, участвующие в пост-пост-транскрипционной регуляции, регулируются пост-транскрипционно. [15] [16] [17] Для RBP дрозофилы, связанных со сплайсингом или бессмысленным распадом, анализ профилей белок-белкового и белок-РНК взаимодействия выявил повсеместные взаимодействия с РНК и белковыми продуктами одного и того же гена. [17] Остается неясным, обусловлены ли эти наблюдения проксимальными рибосомами или опосредованными рибосомами контактами, или некоторые белковые комплексы, в частности РНП, подвергаются котрансляционной сборке.
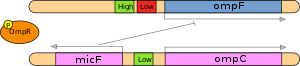
Эта область исследований недавно приобрела большую важность из-за растущего количества доказательств того, что посттранскрипционная регуляция играет большую роль, чем предполагалось ранее. Несмотря на то, что белок с доменами связывания ДНК более распространен, чем белок с доменами связывания РНК, недавнее исследование Чидла и др. (2005) показало, что во время активации Т-клеток 55% значительных изменений на уровне устойчивого состояния не имели соответствующих изменений на уровне транскрипции, что означает, что они были результатом только регуляции стабильности. [19]
Более того, РНК, обнаруженная в ядре, сложнее, чем та, что обнаружена в цитоплазме: более 95% (оснований) РНК, синтезированной РНК-полимеразой II, никогда не достигает цитоплазмы . Основная причина этого — удаление интронов , которые составляют 80% от общего числа оснований. [20] Некоторые исследования показали, что даже после обработки уровни мРНК между цитоплазмой и ядром сильно различаются. [21]
Биология развития является хорошим источником моделей регуляции, но из-за технических трудностей было легче определить каскады факторов транскрипции, чем регуляцию на уровне РНК. Фактически, известно, что несколько ключевых генов, таких как нано, связывают РНК, но часто их цели неизвестны. [22] Хотя РНК-связывающие белки могут регулировать посттранскрипционно большое количество транскриптома, нацеливание на один ген представляет интерес для научного сообщества по медицинским причинам, это РНК-интерференция и микроРНК , которые являются примерами посттранскрипционной регуляции, которые регулируют разрушение РНК и изменяют структуру хроматина. Для изучения посттранскрипционной регуляции используются несколько методов, таких как RIP-Chip ( иммунопреципитация РНК на чипе). [23]
Дефицит экспрессии гена репарации ДНК встречается при многих видах рака (см. Дефект репарации ДНК и риск рака и микроРНК и репарация ДНК ). Измененная экспрессия микроРНК (миРНК), которая либо снижает точность репарации ДНК , либо увеличивает неточную микрогомологично-опосредованную репарацию концов (MMEJ), часто наблюдается при раке. Дефицит точной репарации ДНК может быть основным источником высокой частоты мутаций при раке (см. частоты мутаций при раке ). Репрессия генов репарации ДНК при раке за счет изменений уровней микроРНК может быть более частой причиной репрессии, чем мутация или эпигенетическое метилирование генов репарации ДНК.
Например, BRCA1 используется в точном пути гомологичной рекомбинационной репарации (HR). Дефицит BRCA1 может вызвать рак молочной железы. [24] Снижение регуляции BRCA1 из-за мутации происходит примерно в 3% случаев рака молочной железы. [25] Снижение регуляции BRCA1 из-за метилирования его промотора происходит примерно в 14% случаев рака молочной железы. [26] Однако повышенная экспрессия miR-182 снижает регуляцию мРНК и экспрессию белка BRCA1, [27] а повышенная miR-182 обнаруживается в 80% случаев рака молочной железы. [28]
В другом примере мутировавшая конститутивно (постоянно) экспрессируемая версия онкогена c -Myc обнаруживается во многих видах рака. Среди многих функций c-Myc негативно регулирует микроРНК miR-150 и miR-22. Эти микроРНК обычно подавляют экспрессию двух генов, необходимых для MMEJ, Lig3 и Parp1 , тем самым подавляя этот неточный, мутагенный путь репарации ДНК. Муварак и др. [29] показали, что при лейкемиях конститутивная экспрессия c-Myc, приводящая к снижению регуляции miR-150 и miR-22, допускает повышенную экспрессию Lig3 и Parp1 . Это вызывает геномную нестабильность за счет увеличения неточного восстановления ДНК MMEJ и, вероятно, способствует прогрессированию лейкемии.
Чтобы показать частую способность микроРНК изменять экспрессию репарации ДНК, Хатано и др. [30] провели крупное скрининговое исследование, в котором 810 микроРНК были трансфицированы в клетки, которые затем подвергались ионизирующему излучению (ИИ). Для 324 из этих микроРНК репарация ДНК была снижена (клетки были убиты более эффективно ИИ) после трансфекции. Для еще 75 микроРНК репарация ДНК была повышена, с меньшей гибелью клеток после ИИ. Это указывает на то, что изменения в микроРНК часто могут снижать регуляцию репарации ДНК, вероятно, важный ранний шаг в прогрессировании рака.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )