Озоно - кислородный цикл — это процесс, посредством которого озон постоянно регенерируется в стратосфере Земли , преобразуя ультрафиолетовое излучение ( УФ) в тепло . В 1930 году Сидни Чепмен разгадал химию . Ученые-атмосферники обычно называют этот процесс циклом Чепмена .
Большая часть производства озона происходит в тропической верхней стратосфере и мезосфере. Общая масса озона, производимого в день на земном шаре, составляет около 400 миллионов метрических тонн. Глобальная масса озона относительно постоянна и составляет около 3 миллиардов метрических тонн, а это означает, что Солнце производит около 12% озонового слоя каждый день. [1]
Цикл Чепмена описывает основные реакции, естественным образом определяющие в первом приближении концентрацию озона в стратосфере. Он включает в себя четыре процесса – и пятый, менее важный – все с участием атомов и молекул кислорода, а также УФ-излучения: [2]
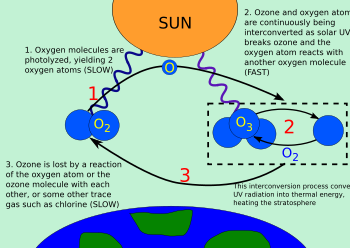
Молекула кислорода расщепляется ( фотолизируется ) под действием высокочастотного УФ-излучения (верхний конец УФ-В , УФ-С и выше) на два атома кислорода (см. рисунок):
Затем каждый атом кислорода может объединиться с молекулой кислорода с образованием молекулы озона:
Молекулы озона, образующиеся в результате реакции (вверху), поглощают излучение с соответствующей длиной волны между УФ-С и УФ-В . Трехатомная молекула озона превращается в двухатомный молекулярный кислород плюс свободный атом кислорода (см. рисунок):
Образующийся атомарный кислород может вступать в реакцию с другой молекулой кислорода с образованием озона посредством реакции образования озона (реакция 2 выше).
Таким образом, эти две реакции образуют озоно-кислородный цикл, в котором химическая энергия, выделяемая при образовании озона, становится молекулярной кинетической энергией. Конечным результатом цикла является преобразование проникающего УФ-излучения в тепло без каких-либо чистых потерь озона. Поддерживая стабильный баланс озонового слоя и защищая нижние слои атмосферы от вредного УФ-излучения, цикл также обеспечивает один из двух основных источников тепла в стратосфере (вторым является кинетическая энергия, высвобождаемая при фотолизе O 2 на отдельные атомы O). .
Если атом кислорода и молекула озона встречаются, они рекомбинируются с образованием двух молекул кислорода:
Два атома кислорода могут вступить в реакцию с образованием одной молекулы кислорода:
Заметим, что реакция 5 имеет наименьшее значение в стратосфере, так как в нормальных условиях концентрация атомов кислорода значительно ниже, чем концентрация двухатомных молекул кислорода. Поэтому эта реакция менее распространена, чем образование озона (реакция 2).
Общее количество озона в стратосфере определяется балансом между образованием солнечной радиации и его удалением. Скорость удаления низкая, поскольку концентрация свободных атомов О очень мала.
В дополнение к этим пяти реакциям, некоторые свободные радикалы (наиболее важными из которых являются гидроксил (OH), оксид азота (NO) и атомарный хлор (Cl) и бром (Br)) катализируют реакцию рекомбинации , приводящую к образованию озонового слоя, который тоньше, чем было бы, если бы катализаторов не было.
Большая часть OH и NO естественным образом присутствует в стратосфере, но деятельность человека – особенно выбросы хлорфторуглеродов ( CFC ) и галонов – значительно увеличила концентрацию Cl и Br, что привело к истощению озона . Каждый атом Cl или Br может катализировать десятки тысяч реакций разложения, прежде чем он будет удален из стратосферы.
При заданных относительных концентрациях реагентов скорости образования озона и рекомбинации кислорода (реакции 2 и 5) пропорциональны кубу плотности воздуха, а скорость конверсии озона (реакция 4) пропорциональна квадрату плотности воздуха, а реакции фотодиссоциации (реакции 1 и 3) имеют линейную зависимость от плотности воздуха. Таким образом, в верхних слоях термосферы, где плотность воздуха очень низкая, а поток фотонов высок, фотодиссоциация кислорода происходит быстро, а образование озона низкое, поэтому его концентрация низкая. Таким образом, наиболее важными реакциями являются фотодиссоциация кислорода и рекомбинация кислорода, при этом большая часть молекул кислорода диссоциирует на атомы кислорода. [3]
Когда мы опускаемся в нижние слои термосферы (например, на высоту 100 км и ниже), поток фотонов с длиной волны <170 нм резко падает из-за поглощения кислородом в реакции фотодиссоциации кислорода (реакция 1). Этот режим длины волны имеет самое высокое сечение этой реакции (10 -17 см 2 на молекулу кислорода), и, таким образом, скорость фотодиссоциации кислорода на молекулу кислорода значительно снижается на этих высотах - с более чем 10 -7 см 2 в секунду (примерно один раз в секунду). в месяц) на 100 км до 10 -8 в секунду (примерно раз в несколько лет) на 80 км. [4] В результате концентрация атомарного кислорода (как относительная, так и абсолютная) резко снижается, и образование озона (реакция 2) продолжается, что приводит к небольшому, но немалому присутствию озона. [5]
Обратите внимание, что температура также падает с уменьшением высоты, поскольку более низкие скорости фотодиссоциации фотонов означают меньшее выделение тепла на молекулу воздуха.
Нечетные виды кислорода (атомарный кислород и озон) имеют чистую скорость образования только за счет диссоциации кислорода (реакция 1) и чистое разрушение либо за счет конверсии озона, либо за счет рекомбинации кислорода (реакции 4 и 5). В установившемся режиме эти процессы сбалансированы, поэтому скорости этих реакций подчиняются:
В устойчивом состоянии образование озона также сбалансировано с его удалением. так:
Отсюда следует, что:
Правая часть представляет собой общую скорость фотодиссоциации кислорода или озона.
Ниже термосферы концентрация атомарного кислорода очень низка по сравнению с молекулярным кислородом. [6] Следовательно, атомы кислорода гораздо чаще сталкиваются с молекулами кислорода (двухатомными), чем с другими атомами кислорода, что делает рекомбинацию кислорода (реакция 5) гораздо более редкой, чем образование озона (реакция 2). Следуя установившемуся соотношению между скоростями реакций, мы можем поэтому аппроксимировать: [7]
В мезосфере фотодиссоциация кислорода доминирует над фотодиссоциацией озона, поэтому имеем примерно: [4]
Таким образом, озон в основном удаляется путем преобразования озона. Как создание, так и преобразование озона линейно зависят от концентрации атомов кислорода, но при образовании озона атом кислорода должен одновременно столкнуться с молекулой кислорода и другой молекулой воздуха (обычно азота), тогда как при преобразовании озона атом кислорода должен столкнуться только с молекулой озона. Таким образом, когда обе реакции сбалансированы, соотношение концентраций озона и молекулярного кислорода примерно пропорционально плотности воздуха.
Следовательно, относительная концентрация озона выше на меньших высотах, где выше плотность воздуха. Эта тенденция продолжается в некоторой степени ниже в стратосфере, и, таким образом, по мере того, как мы поднимаемся с высоты 60 км на высоту 30 км, плотность воздуха и относительная концентрация озона увеличиваются примерно в 40-50 раз. [8] [9] [10]
Поглощение кислородом в мезосфере и термосфере (в реакции фотодиссоциации кислорода) уменьшает поток фотонов на длинах волн ниже 200 нанометров, где в фотодиссоциации кислорода преобладают полосы Шумана-Рунге и континуум , с сечением до 10 -17 см 2 . Из-за этого поглощения поток фотонов этих длин волн в стратосфере настолько мал, что в фотодиссоциации кислорода начинает преобладать полоса Герцберга с длиной волны фотонов 200-240 нм, хотя сечение этого процесса составляет всего 10 - 24 - 10 -23 см 2 . Скорость фотодиссоциации озона, приходящаяся на одну молекулу озона, имеет сечение на 6 порядков выше в диапазоне длин волн 220–300 нм. При концентрациях озона порядка 10 -6 -10 -5 по отношению к молекулярному кислороду фотодиссоциация озона становится доминирующей реакцией фотодиссоциации, и большая часть тепла стратосферы генерируется посредством этого процесса, при этом самая высокая скорость выделения тепла на молекулу находится на верхнем пределе. стратосферы ( стратопауза ), где концентрация озона уже относительно высока, в то время как поток УФ-излучения в этих длинах волн все еще высок, прежде чем он истощается в результате того же процесса фотодиссоциации.
В дополнение к тому, что фотодиссоциация озона становится более доминирующей реакцией удаления, каталитическое разрушение озона за счет свободных радикалов (в основном атомарного водорода , гидроксила , оксида азота , хлора и бромида ) увеличивает эффективную скорость реакции конверсии озона. Оба процесса способствуют увеличению удаления озона, что приводит к более умеренному увеличению относительной концентрации озона по мере уменьшения высоты, даже несмотря на то, что плотность воздуха продолжает увеличиваться. [4]
Из-за растущей плотности как озона, так и кислорода по мере того, как мы спускаемся на меньшие высоты, поток УФ-фотонов на длинах волн ниже 300 нм существенно уменьшается, а скорость фотодиссоциации кислорода падает ниже 10 -9 в секунду на молекулу на расстоянии 30 км. [4] С уменьшением скорости фотодиссоциации кислорода нечетные формы кислорода (атомарный кислород и молекулы озона) практически не образуются de novo (вместо того, чтобы превращаться друг в друга в результате других реакций), и большая часть атомарного кислорода, необходимого для создания озона, образуется практически исключительно за счет удаления озона путем фотодиссоциации озона. Таким образом, озон истощается, когда мы опускаемся ниже высоты 30 км, и достигает очень низких концентраций в тропопаузе . [8]
В тропосфере образование и разрушение озона больше не контролируется озоно-кислородным циклом. Скорее, в химии тропосферного озона сегодня преобладают промышленные загрязнители и другие газы вулканического происхождения. [4]