Урокиназа , также известная как активатор плазминогена урокиназного типа ( uPA ), представляет собой сериновую протеазу, присутствующую в организме человека и других животных. Человеческий белок урокиназы был открыт, но не назван, Макфарлейном и Пиллингом в 1947 году. [5] Урокиназа была первоначально выделена из мочи человека , и она также присутствует в крови и во внеклеточном матриксе многих тканей. Основным физиологическим субстратом этого фермента является плазминоген , который является неактивной формой ( зимогеном ) сериновой протеазы плазмина . Активация плазмина запускает протеолитический каскад, который в зависимости от физиологической среды участвует в тромболизисе или деградации внеклеточного матрикса. Этот каскад был вовлечен в сосудистые заболевания и прогрессирование рака. [6]
Урокиназа кодируется у людей геном PLAU , что означает «активатор плазминогена, урокиназа». [7] Тот же символ представляет ген у других видов животных.
Ген PLAU кодирует сериновую протеазу ( EC 3.4.21.73), участвующую в деградации внеклеточного матрикса и, возможно, в миграции и пролиферации опухолевых клеток. Специфический полиморфизм в этом гене может быть связан с болезнью Альцгеймера позднего начала, а также со сниженным сродством к связыванию фибрина. Белок, кодируемый этим геном, превращает плазминоген в плазмин путем специфического расщепления связи Arg-Val в плазминогене. Пропротеин этого гена расщепляется по связи Lys-Ile плазмином с образованием двухцепочечного производного, в котором одна дисульфидная связь соединяет аминоконцевую A-цепь с каталитически активной карбоксиконцевой B-цепью. Это двухцепочечное производное также называется HMW-uPA (высокомолекулярный uPA). HMW-uPA может быть далее преобразован в LMW-uPA (низкомолекулярный uPA) путем расщепления цепи A на короткую цепь A (A1) и аминоконцевой фрагмент. LMW-uPA протеолитически активен, но не связывается с рецептором uPA. [8]
Урокиназа — это белок из 411 остатков , состоящий из трех доменов : домен сериновой протеазы (состоящий из остатков 159–411), домен крингла (состоящий из остатков 50–131) и домен, подобный EGF (состоящий из остатков 1–49). Домен крингла и домен сериновой протеазы соединены междоменным линкером или соединительным пептидом (состоящим из остатков 132–158). Урокиназа синтезируется в форме зимогена (проурокиназа или одноцепочечная урокиназа) и активируется протеолитическим расщеплением между Lys158 и Ile159. Две полученные цепи удерживаются вместе дисульфидной связью между Cys148 и Cys279 . [ 9]
По сравнению с системой млекопитающих, данио рерио (Danio rerio) содержит два ортолога урокиназы, которые были охарактеризованы как zfuPA-a и zfuPA-b. zfuPA-a отличается от uPA млекопитающих отсутствием экзонной последовательности , кодирующей домен связывания uPAR (рецептор урокиназы); в то время как у zfuPA-b отсутствуют два цистеина домена, подобного эпидермальному фактору роста. zfuPA-b также не обладает связывающей активностью в лейкоцитах рыб или линиях рыбных клеток. Связывание uPAR в системе млекопитающих необходимо для активности урокиназы и uPAR, поскольку он также функционирует как рецептор адгезии из-за своего сродства к витронектину , интегринам и другим протеазам, таким как PAI-1 . Отсутствие области связывания uPAR в uPA данио рерио предполагает, что uPA данио рерио функционирует без связывания uPAR. [10]
Наиболее важными ингибиторами урокиназы являются серпины ингибитор активатора плазминогена-1 (PAI-1) и ингибитор активатора плазминогена-2 (PAI-2), которые необратимо ингибируют активность протеазы. Во внеклеточном матриксе урокиназа связана с клеточной мембраной посредством взаимодействия с рецептором урокиназы .
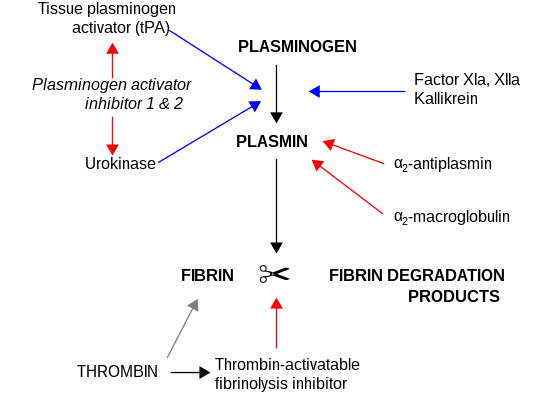
uPa также взаимодействует с ингибитором протеина C. [ 11] [12]
zfuPA-a и zfuPA-b являются слабыми активаторами человеческого плазминогена , в то время как человеческий uPA является слабым активатором лососевого плазминогена. Основное различие между uPA данио-рерио и человеческим uPA заключается в домене EGF. [10]
Установлено, что повышенные уровни экспрессии урокиназы и нескольких других компонентов системы активации плазминогена коррелируют со злокачественностью опухоли . Считается, что деградация ткани после активации плазминогена облегчает инвазию ткани и, таким образом, способствует метастазированию . [13] Активатор плазминогена урокиназного типа (uPA) чаще ассоциируется с прогрессированием рака, чем тканевой активатор плазминогена (tPA). [14] Это делает uPA привлекательной мишенью для лекарственных средств , и поэтому были предприняты попытки использовать ингибиторы в качестве противораковых агентов. [15] [16] Однако несовместимость между системами человека и мышей затрудняет клиническую оценку этих агентов. Более того, урокиназа используется нормальными клетками для ремоделирования тканей и роста сосудов, что требует различения особенностей урокиназы, связанных с раком, для специфического нацеливания. [13]
Распад uPA внеклеточного матрикса имеет решающее значение для инициирования ангиогенеза , который связан с ростом рака. [14]
Уровень антигена uPA повышен в тканях рака молочной железы, что коррелирует с плохим прогнозом у пациентов с раком молочной железы. [14] По этой причине uPA можно использовать в качестве диагностического биомаркера при раке молочной железы. [14]
Взаимодействуя с рецептором урокиназы , урокиназа влияет на ряд других аспектов биологии рака, таких как клеточная адгезия, миграция и клеточные митотические пути.
По состоянию на 7 декабря 2012 года Месупрон ( упамостат ), ингибитор сериновой протеазы с небольшой молекулой, разработанный фармацевтической компанией WILEX, завершил испытания фазы II. [17] Месупрон, по-видимому, безопасен в сочетании с химиотерапевтическим препаратом капецитабин для выживаемости без прогрессирования рака молочной железы у человека. [18]
Урокиназа эффективна для восстановления потока во внутривенных катетерах, заблокированных свернувшейся кровью или фибрином (очищение катетера). Катетеры широко используются для проведения лечения пациентам в таких целях, как диализ, питание, лечение антибиотиками и лечение рака. Примерно 25% катетеров блокируются, что означает, что пострадавшие пациенты не могут получать лечение, пока катетер не будет очищен или заменен. Урокиназа также используется клинически в качестве тромболитического средства при лечении тяжелого или массивного тромбоза глубоких вен , окклюзионной болезни периферических артерий, тромбоэмболии легочной артерии , острого инфаркта миокарда (ОИМ, сердечный приступ) и закупоренных диализных канюль (очищение катетера). Он также вводится внутриплеврально для улучшения дренирования сложных плевральных выпотов и эмпием. Урокиназа продается под названием Кинлитик (ранее Аббокиназа) и конкурирует с рекомбинантным тканевым активатором плазминогена (например, альтеплазой) в качестве тромболитического препарата.
Все активаторы плазминогена (урокиназа, tPA) катализируют выработку плазмина, что в свою очередь приводит к разрушению структуры фибриновой сетки в тромбах. Хотя есть общие черты в способе действия урокиназы и tPA, урокиназа имеет некоторые преимущества для лечения периферических тромбов (легочная эмболия, тромбоз глубоких вен, окклюзионная болезнь периферических артерий).
В отличие от tPA, который активируется путем связывания с фибрином внутри сгустков, урокиназа не секвестрируется фибрином и, следовательно, не атакует специально гемостатические сгустки. Это снижает вероятность того, что урокиназа расщепит такие гемостатические сгустки, которые необходимы для постоянного восстановления кровеносных сосудов по всему телу. Растворение этих «хороших» сгустков может привести к серьезным нежелательным явлениям через геморрагическое кровотечение. Годы клинических исследований подтвердили преимущество безопасности использования урокиназы. [19] [20] Следовательно, урокиназа преимущественно использовалась при тромбозе глубоких вен и окклюзионной болезни периферических артерий, где она вводится непосредственно в место сгустка, в то время как tPA предпочтительнее при остром инфаркте миокарда, где периферическое кровотечение является вторичным фактором.
Революционный метод производства урокиназы был запатентован Эвелин Николь в 1976 году (патент США № 3,930,944). Считалось, что Николь была первой афроамериканкой, получившей патент в области молекулярной биологии. [21]
О наличии фибринолитического фермента в моче человека сообщили в 1947 году, без указания названия такого фермента, стоящего за его эффектом. [22] В 1952 году очищенная форма фермента была извлечена из мочи человека и названа «урокиназа» от «мочеиспускательная киназа». [23] Полный текст этой статьи утерян, и единственная ссылка указывает на реферат списка статей, прочитанных на конференции в том же журнале. [24] Несколько других статей об очистке были опубликованы независимо примерно в то же время. К 1960 году все еще было неясно , связана ли активация плазминогена с протеазой, но считается, что киназа играет определенную роль независимо. [25]
Нормальная человеческая и собачья моча содержит фибринолизин (плазмин) и мощный активатор профибринолизина (плазминоген). Активатор, который мы обозначили урокиназой, можно концентрировать и частично очищать методами ацетонового или спиртового фракционирования.