Уравнение Вант-Гоффа связывает изменение константы равновесия , K eq , химической реакции с изменением температуры , T , учитывая стандартное изменение энтальпии , Δ r H ⊖ , для процесса. Нижний индекс означает «реакция», а верхний индекс означает «стандарт». Оно было предложено голландским химиком Якобусом Хенрикусом ван-Гоффом в 1884 году в его книге Études de Dynamique chimique ( Исследования по динамической химии ). [1]
Уравнение Вант-Гоффа широко используется для исследования изменений функций состояния в термодинамической системе . График Вант-Гоффа , который выводится из этого уравнения, особенно эффективен для оценки изменения энтальпии и энтропии химической реакции .
Стандартное давление , , используется для определения исходного состояния для уравнения Вант-Гоффа, которое имеет вид [2] [3]
где ln обозначает натуральный логарифм , — термодинамическая константа равновесия , а R — идеальная газовая постоянная . Это уравнение является точным при любой температуре и всех давлениях, выведенных из требования, чтобы свободная энергия Гиббса реакции была стационарной в состоянии химического равновесия .
На практике уравнение часто интегрируется между двумя температурами, предполагая, что стандартная энтальпия реакции постоянна (и, кроме того, она также часто предполагается равной своему значению при стандартной температуре ). Поскольку в реальности и стандартная энтропия реакции изменяются с температурой для большинства процессов, [4] интегрированное уравнение является лишь приближенным. На практике также делаются приближения к коэффициентам активности в пределах константы равновесия.
Основное применение интегрированного уравнения заключается в оценке новой константы равновесия при новой абсолютной температуре , предполагающей постоянное изменение стандартной энтальпии в диапазоне температур. Чтобы получить интегрированное уравнение, удобно сначала переписать уравнение Ван 'т-Гоффа как [2]
Определенный интеграл между температурами T 1 и T 2 тогда равен
В этом уравнении K 1 — константа равновесия при абсолютной температуре T 1 , а K 2 — константа равновесия при абсолютной температуре T 2 .
Объединяя известную формулу для свободной энергии Гиббса реакции
где S — энтропия системы, с уравнением изотермы свободной энергии Гиббса: [5]
мы получаем
Дифференцирование этого выражения по переменной T при допущении, что и не зависят от T, дает уравнение Ван 'т-Гоффа. Ожидается, что эти предположения несколько нарушатся при больших колебаниях температуры.
При условии, что и являются постоянными, предыдущее уравнение дает ln K как линейную функцию 1/Т и, следовательно, известна как линейная форма уравнения Вант-Гоффа. Следовательно, когда диапазон температур достаточно мал, чтобы стандартная энтальпия реакции и энтропия реакции были по существу постоянными, график натурального логарифма константы равновесия против обратной температуры дает прямую линию. Наклон линии можно умножить на газовую постоянную R , чтобы получить стандартное изменение энтальпии реакции, а отсекаемый элемент можно умножить на R, чтобы получить стандартное изменение энтропии .
Изотерму Вант-Гоффа можно использовать для определения температурной зависимости свободной энергии Гиббса реакции для нестандартных состояний реакций при постоянной температуре: [6]
где — свободная энергия Гиббса реакции в нестандартных состояниях при температуре , — свободная энергия Гиббса для реакции при , — степень реакции , а Q r — термодинамический коэффициент реакции . Поскольку , температурная зависимость обоих членов может быть описана уравнениями Ван-т'Гоффа как функция T . Это находит применение в области электрохимии . в частности, при изучении температурной зависимости гальванических элементов.
Изотерму также можно использовать при фиксированной температуре для описания закона действующих масс . Когда реакция находится в равновесии , Q r = K eq и . В противном случае изотерма Вант-Гоффа предсказывает направление, в котором система должна сместиться для достижения равновесия; когда Δ r G < 0 , реакция движется в прямом направлении, тогда как когда Δ r G > 0 , реакция движется в обратном направлении. См. Химическое равновесие .
Для обратимой реакции константа равновесия может быть измерена при различных температурах. Эти данные могут быть нанесены на график с ln K eq на оси y и 1/Т на оси x . Данные должны иметь линейную зависимость, уравнение которой можно найти, подгоняя данные с помощью линейной формы уравнения Ван 'т-Гоффа
Этот график называется «графиком Ван 'т Хоффа» и широко используется для оценки энтальпии и энтропии химической реакции . Из этого графика, − ΔrH/Р — наклон, и ΔrS/Р — точка пересечения линейной аппроксимации.
Измеряя константу равновесия , K eq , при различных температурах, график Вант-Гоффа можно использовать для оценки реакции при изменении температуры. [7] [8] Зная наклон и отсекаемый отрезок графика Вант-Гоффа, можно легко получить энтальпию и энтропию реакции, используя
График Вант-Гоффа можно использовать для быстрого определения энтальпии химической реакции как качественно, так и количественно. Это изменение энтальпии может быть положительным или отрицательным, что приводит к двум основным формам графика Вант-Гоффа.

Для эндотермической реакции тепло поглощается, делая чистое изменение энтальпии положительным. Таким образом, согласно определению наклона:
Когда реакция эндотермическая , ΔrH > 0 (и газовая постоянная R > 0 ), поэтому
Таким образом, для эндотермической реакции график Вант-Гоффа всегда должен иметь отрицательный наклон.
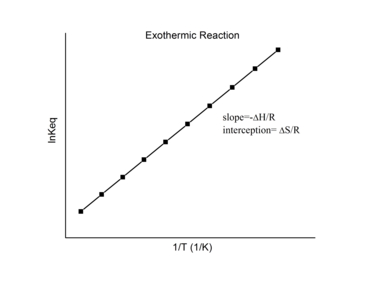
При экзотермической реакции выделяется тепло, что делает чистое изменение энтальпии отрицательным. Таким образом, согласно определению наклона:
Для экзотермической реакции Δ r H < 0 , поэтому
Таким образом, для экзотермической реакции график Вант-Гоффа всегда должен иметь положительный наклон.
На первый взгляд, используя тот факт, что Δ r G ⊖ = − RT ln K = Δ r H ⊖ − T Δ r S ⊖, может показаться, что двух измерений K будет достаточно, чтобы получить точное значение Δ r H ⊖ :
где K 1 и K 2 — значения констант равновесия, полученные при температурах T 1 и T 2 соответственно. Однако точность значений Δ r H ⊖, полученных таким образом, сильно зависит от точности измеренных значений констант равновесия.
Использование распространения ошибки показывает, что ошибка в Δ r H ⊖ будет составлять около 76 кДж/моль, умноженных на экспериментальную неопределенность в (ln K 1 − ln K 2 ) , или около 110 кДж/моль, умноженных на неопределенность в значениях ln K. Аналогичные соображения применимы к энтропии реакции, полученной из Δ r S ⊖ = 1/Т (Δ H ⊖ + RT ln K ) .
Примечательно, что когда константы равновесия измеряются при трех или более температурах, значения Δ r H ⊖ и Δ r S ⊖ часто получаются путем подгонки прямой линии . [9] Ожидается, что ошибка будет уменьшена с помощью этой процедуры, хотя предположение о том, что энтальпия и энтропия реакции постоянны, может оказаться верным, а может и нет. Если есть значительная температурная зависимость в одной или обеих величинах, она должна проявиться в нелинейном поведении на графике Ван 'т-Гоффа; однако, по-видимому, для наблюдения этого потребуется более трех точек данных.

В биологических исследованиях график Ван 'т Хоффа также называется анализом Ван 'т Хоффа. [10] Он наиболее эффективен для определения предпочтительного продукта в реакции. Он может давать результаты, отличающиеся от результатов прямой калориметрии, такой как дифференциальная сканирующая калориметрия или изотермическая титрационная калориметрия, из-за различных эффектов, отличных от экспериментальной ошибки. [11]
Предположим, что в результате реакции образуются два продукта B и C:
В этом случае K eq можно определить как отношение B к C, а не как константу равновесия.
Когда Б/С > 1, B является предпочтительным продуктом, и данные на графике Вант-Гоффа будут находиться в положительной области.
Когда Б/С < 1, C является предпочтительным продуктом, и данные на графике Вант-Гоффа будут находиться в отрицательной области.
Используя эту информацию, анализ Вант-Гоффа может помочь определить наиболее подходящую температуру для нужного продукта.
В 2010 году анализ Вант-Гоффа был использован для определения того, образует ли вода предпочтительно водородную связь с C -концом или N -концом аминокислоты пролина. [12] Константа равновесия для каждой реакции была найдена при различных температурах, и был создан график Вант-Гоффа. Этот анализ показал, что энтальпически вода предпочитала образовывать водородную связь с C -концом, но энтропийно она была более выгодна для водородной связи с N -концом. В частности, они обнаружили, что водородная связь C -конца была благоприятствована 4,2–6,4 кДж/моль. Водородная связь N -конца была благоприятствована 31–43 Дж/(К моль).
Эти данные сами по себе не могли сделать вывод о том, с каким сайтом вода будет предпочтительно связываться водородом, поэтому были проведены дополнительные эксперименты. Было установлено, что при более низких температурах предпочтительным был энтальпийно благоприятный вид, вода, связанная водородом с C -концом. При более высоких температурах предпочтительным был энтропийно благоприятный вид, вода, связанная водородом с N -концом.

Химическая реакция может протекать по разным механизмам при разных температурах. [13]
В этом случае может быть использован график Ван 'т Гоффа с двумя или более линейными аппроксимациями. Каждый линейный аппроксиматор имеет разный наклон и точку пересечения, что указывает на разные изменения энтальпии и энтропии для каждого отдельного механизма. График Ван 'т Гоффа может быть использован для нахождения изменения энтальпии и энтропии для каждого механизма и предпочтительного механизма при разных температурах.
На рисунке в качестве примера реакция протекает по механизму 1 при высокой температуре и по механизму 2 при низкой температуре.

Если энтальпия и энтропия примерно постоянны при изменении температуры в определенном диапазоне, то график Ван 'т-Гоффа приблизительно линеен при построении в этом диапазоне. Однако в некоторых случаях энтальпия и энтропия действительно резко меняются с температурой. Приближение первого порядка заключается в предположении, что два разных продукта реакции имеют разные теплоемкости. Включение этого предположения дает дополнительный член с/Т 2 в выражении для константы равновесия как функции температуры. Затем полиномиальная подгонка может быть использована для анализа данных, которые демонстрируют непостоянную стандартную энтальпию реакции: [14]
где
Таким образом, энтальпию и энтропию реакции можно определить при определенных температурах, даже если существует температурная зависимость.
Соотношение Вант-Гоффа особенно полезно для определения энтальпии мицеллообразования Δ H⊖
мповерхностно-активных веществ по температурной зависимости критической концентрации мицеллообразования (ККМ):
Однако это соотношение теряет свою силу, когда число агрегации также зависит от температуры, и вместо него следует использовать следующее соотношение: [15]
где G N + 1 и G N — свободные энергии поверхностно-активного вещества в мицелле с числом агрегации N + 1 и N соответственно. Этот эффект особенно актуален для неионных этоксилированных поверхностно-активных веществ [16] или блок-сополимеров полиоксипропилена и полиоксиэтилена (полоксамеры, плюроники, синпероники). [17] Расширенное уравнение можно использовать для извлечения чисел агрегации самоорганизующихся мицелл из дифференциальных сканирующих калориметрических термограмм. [18]