Окисление Байера -Виллигера — это органическая реакция , в которой из кетона образуется сложный эфир или из циклического кетона — лактон с использованием пероксикислот или пероксидов в качестве окислителя . [1] Реакция названа в честь Адольфа фон Байера и Виктора Виллигера, которые впервые сообщили о реакции в 1899 году. [1]

На первом этапе механизма реакции пероксикислота протонирует кислород карбонильной группы . [1] Это делает карбонильную группу более восприимчивой к атаке пероксикислоты. [1] Затем пероксикислота атакует углерод карбонильной группы, образуя то, что известно как промежуточное соединение Криге . [1] Благодаря согласованному механизму один из заместителей в кетонной группе мигрирует к кислороду пероксидной группы, в то время как карбоновая кислота уходит. [1] Этот этап миграции считается этапом, определяющим скорость . [2] [3] Наконец, депротонирование иона оксокарбения дает сложный эфир . [1]

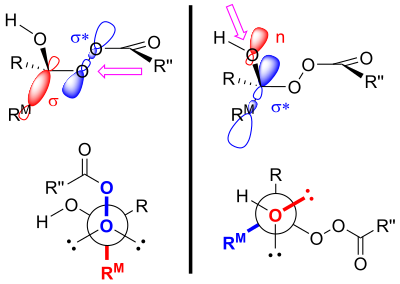
Считается, что продукты окисления Байера-Виллигера контролируются как первичными, так и вторичными стереоэлектронными эффектами . [4] Первичный стереоэлектронный эффект в окислении Байера-Виллигера относится к необходимости связи кислород-кислород в пероксидной группе быть антиперипланарной по отношению к группе, которая мигрирует. [4] [3] Такая ориентация способствует оптимальному перекрытию 𝛔-орбитали мигрирующей группы с 𝛔*-орбиталью пероксидной группы. [1] Вторичный стереоэлектронный эффект относится к необходимости неподеленной пары на кислороде гидроксильной группы быть антиперипланарной по отношению к мигрирующей группе. [4] Это обеспечивает оптимальное перекрытие несвязывающей кислород орбитали с 𝛔*-орбиталью мигрирующей группы. [5] Этот этап миграции также (по крайней мере in silico ) сопровождается двумя или тремя пероксикислотными единицами, позволяющими гидроксильному протону перемещаться в новое положение. [6]
Способность к миграции ранжируется следующим образом: третичная > вторичная > арильная > первичная. [7] Аллильные группы более склонны к миграции, чем первичные алкильные группы, но менее склонны к миграции, чем вторичные алкильные группы. [5] Электроноакцепторные группы на заместителе снижают скорость миграции. [8] Существует два объяснения этой тенденции в способности к миграции. [9] Одно объяснение основано на накоплении положительного заряда в переходном состоянии для распада промежуточного продукта Криге (проиллюстрировано резонансной структурой карбокатиона промежуточного продукта Криге). [9] Имея в виду эту структуру, становится понятным, что заместитель, который может лучше всего поддерживать положительный заряд, будет мигрировать с наибольшей вероятностью. [9] Чем выше степень замещения, тем, как правило, более стабилен карбокатион. [10] Таким образом, наблюдается тенденция третичный > вторичный > первичный.

Другое объяснение использует стереоэлектронные эффекты и стерические аргументы. [11] Как уже упоминалось, заместитель, который является антиперипланарным по отношению к пероксидной группе в переходном состоянии, будет мигрировать. [4] Это переходное состояние имеет гош-взаимодействие между пероксикислотой и немигрирующим заместителем. [11] Если более объемная группа размещена антиперипланарно по отношению к пероксидной группе, гош-взаимодействие между заместителем в образующемся эфире и карбонильной группой пероксикислоты будет уменьшено. [11] Таким образом, именно более объемная группа предпочтет быть антиперипланарной по отношению к пероксидной группе, что повышает ее способность к миграции. [11]

Мигрирующая группа в ациклических кетонах, как правило, не является 1° алкильной группой. Однако их можно убедить мигрировать в первую очередь по сравнению с группами 2° или 3°, используя CF 3 CO 3 H или BF 3 + H 2 O 2 в качестве реагентов. [12]
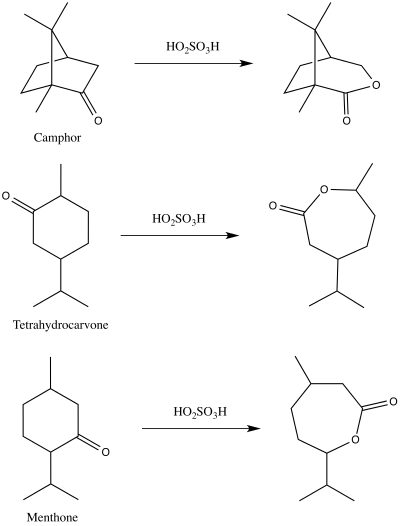
В 1899 году Адольф Байер и Виктор Виллигер впервые опубликовали демонстрацию реакции, которую мы теперь знаем как окисление Байера-Виллигера. [13] [14] Они использовали пероксимоносерную кислоту для получения соответствующих лактонов из камфоры , ментона и тетрагидрокарвона. [14] [15]
Было предложено три механизма реакции окисления Байера-Виллигера, которые, казалось, соответствовали наблюдаемым результатам реакции. [16] Эти три механизма реакции можно разделить на два пути атаки пероксикислот — либо на кислород, либо на углерод карбонильной группы . [17] Атака на кислород может привести к двум возможным промежуточным продуктам : Байер и Виллигер предложили промежуточный диоксиран , в то время как Георг Виттиг и Густав Пипер предложили пероксид без образования диоксирана. [17] Атака углеродом была предложена Рудольфом Криге . [17] В этом пути перкислота атакует карбонильный углерод, производя то, что сейчас известно как промежуточный продукт Криге . [17]
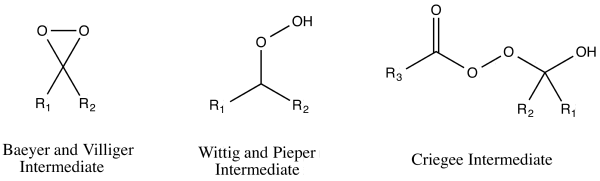
В 1953 году Уильям фон Эггерс Деринг и Эдвин Дорфман выяснили правильный путь для механизма реакции окисления Байера-Виллигера, используя мечение бензофенона кислородом-18 . [16] Каждый из трех различных механизмов приведет к разному распределению меченых продуктов. Промежуточный продукт Криге приведет к продукту, меченому только по карбонильному кислороду. [16] Продукт промежуточного продукта Виттига и Пипера мечен только по алкоксигруппе эфира. [16] Промежуточный продукт Байера и Виллигера приводит к распределению 1:1 обоих вышеуказанных продуктов. [16] Результат эксперимента по мечению подтвердил промежуточный продукт Криге, [16] который в настоящее время является общепринятым путем. [1]
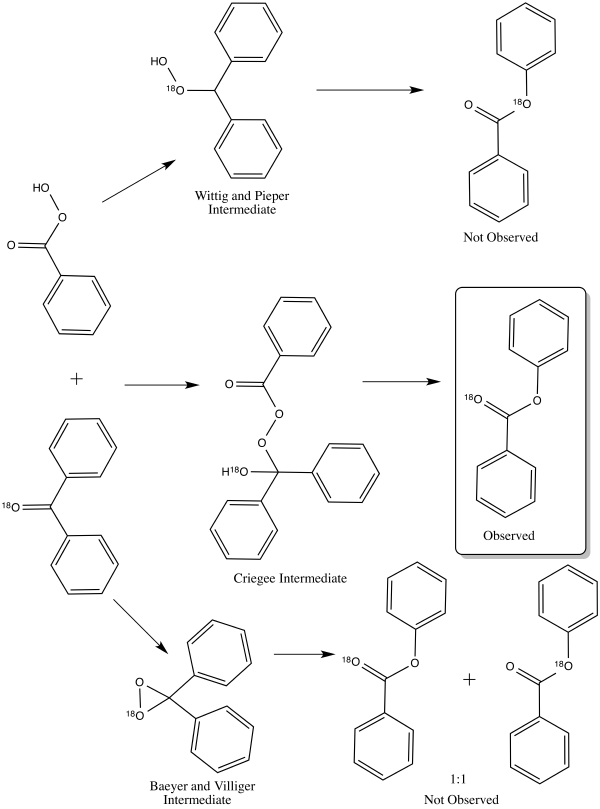
Миграция не изменяет стереохимию переносимой группы, то есть она стереосохраняющая . [18] [19]
Хотя для окисления по Байеру-Виллигеру используется множество различных пероксикислот, некоторые из наиболее распространенных окислителей включают мета -хлорпербензойную кислоту (mCPBA) и трифторперуксусную кислоту (TFPAA). [2] Общая тенденция заключается в том, что более высокая реакционная способность коррелирует с более низким pK a (т. е.: более высокой кислотностью) соответствующей карбоновой кислоты (или спирта в случае пероксидов). [5] Таким образом, тенденция реакционной способности показывает TFPAA > 4-нитропербензойная кислота > mCPBA и пермуравьиная кислота > перуксусная кислота > перекись водорода > трет-бутилгидропероксид . [5] Пероксиды гораздо менее реакционноспособны, чем пероксикислоты. [2] Использование перекиси водорода даже требует катализатора . [7] [20] Кроме того, использование органических пероксидов и перекиси водорода имеет тенденцию генерировать большую побочную реактивность из-за их разнородности. [21]
Использование пероксикислот и пероксидов при выполнении окисления Байера-Виллигера может вызвать нежелательное окисление других функциональных групп . [22] Алкены и амины — это лишь некоторые из групп, которые могут быть окислены . [22] Например, алкены в субстрате, особенно богатые электронами, могут быть окислены до эпоксидов . [22] [23] Однако были разработаны методы, которые позволят обеспечить толерантность этих функциональных групп. [22] В 1962 году Дж. Б. Пейн сообщил, что использование перекиси водорода в присутствии селенового катализатора приведет к образованию эпоксида из алкенилкетонов, в то время как использование пероксиуксусной кислоты приведет к образованию эфира. [24]

Использование перекиси водорода в качестве окислителя было бы выгодным, делая реакцию более экологически чистой, поскольку единственным побочным продуктом является вода. [7] Сообщалось, что производные бензолселениновой кислоты в качестве катализаторов дают высокую селективность с перекисью водорода в качестве окислителя. [25] Другой класс катализаторов, которые показывают высокую селективность с перекисью водорода в качестве окислителя, - это твердые катализаторы на основе кислот Льюиса, такие как станносиликаты. [26] Среди станносиликатов, особенно зеотип Sn-бета и аморфный Sn-MCM-41, показывают многообещающую активность и близкую к полной селективность по отношению к желаемому продукту. [27] [28]
Были попытки использовать металлоорганические катализаторы для проведения энантиоселективных реакций окисления Байера-Виллигера. [7] В первом зарегистрированном случае такого окисления прохирального кетона в качестве окислителя использовался дикислород с медным катализатором. [23] Затем последовали другие катализаторы, включая соединения платины и алюминия . [23]
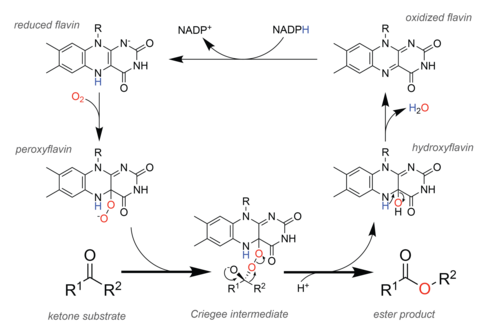
В природе ферменты , называемые монооксигеназами Байера-Виллигера (БВМО), выполняют окисление аналогично химической реакции. [29] Для облегчения этой химии БВМО содержат кофактор флавинадениндинуклеотида (ФАД) . [30] В каталитическом цикле (см. рисунок справа) клеточный окислительно-восстановительный эквивалент НАДФН сначала восстанавливает кофактор, что позволяет ему впоследствии реагировать с молекулярным кислородом . Полученный пероксифлавин является каталитическим образованием, окисляющим субстрат , и теоретические исследования предполагают, что реакция протекает через тот же промежуточный продукт Криге, что и в химической реакции. [31] После стадии перегруппировки, образующей эфирный продукт, остается гидроксифлавин, который спонтанно отщепляет воду, образуя окисленный флавин, тем самым замыкая каталитический цикл.
BVMO тесно связаны с флавинсодержащими монооксигеназами (FMO), [32] ферментами, которые также встречаются в организме человека и функционируют в системе метаболической детоксикации печени на передовой линии вместе с монооксигеназами цитохрома P450 . [33] Фактически было показано, что человеческий FMO5 способен катализировать реакции Байера-Виллигера, что указывает на то, что эта реакция может происходить и в организме человека. [34]
BVMO широко изучались из-за их потенциала в качестве биокатализаторов , то есть для применения в органическом синтезе. [35] Учитывая экологические проблемы для большинства химических катализаторов, использование ферментов считается более экологичной альтернативой. [29] BVMO, в частности, интересны для применения, поскольку они соответствуют ряду критериев, обычно искомых в биокатализе: помимо их способности катализировать синтетически полезную реакцию, было обнаружено, что некоторые природные гомологи имеют очень большой субстратный охват (то есть их реакционная способность не ограничивается одним соединением, как часто предполагается в ферментативном катализе), [36] их можно легко производить в больших масштабах, и поскольку была определена трехмерная структура многих BVMO, ферментная инженерия может быть применена для получения вариантов с улучшенной термостабильностью и/или реакционной способностью. [37] [38] Другим преимуществом использования ферментов для реакции является их часто наблюдаемая регио- и энантиоселективность, обусловленная стерическим контролем ориентации субстрата во время катализа в активном центре фермента . [29] [35]
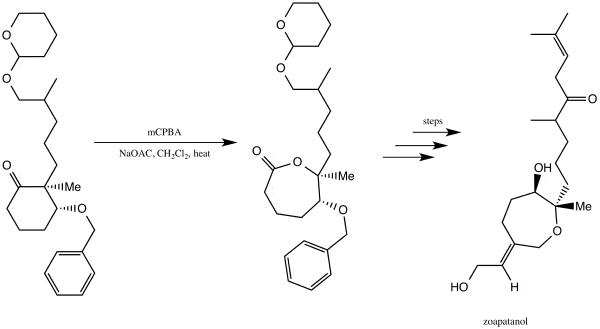
Зоапатанол — это биологически активная молекула, которая естественным образом встречается в растении зеопатанол, которое использовалось в Мексике для приготовления чая, способного вызывать менструацию и роды. [39] В 1981 году Винаяк Кейн и Дональд Дойл сообщили о синтезе зоапатанола. [40] [41] Они использовали окисление Байера-Виллигера для получения лактона , который послужил решающим строительным блоком, что в конечном итоге привело к синтезу зоапатанола. [40] [41]
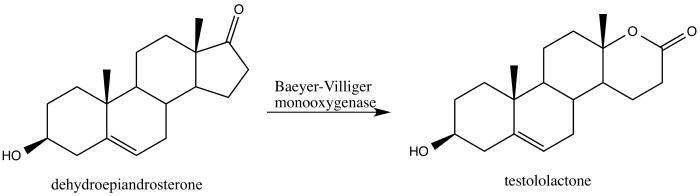
В 2013 году Алина Свиздор сообщила о трансформации стероида дегидроэпиандростерона в противораковый агент тестололактон с помощью окисления Байера-Виллигера, вызванного грибком, который продуцирует монооксигеназы Байера-Виллигера. [42]