Реакция Генри — классическая реакция образования связи углерод-углерод в органической химии . Открытая в 1895 году бельгийским химиком Луи Генри (1834–1913), она представляет собой соединение нитроалкана и альдегида или кетона в присутствии основания с образованием β-нитроспиртов. [1] [2] [3] Этот тип реакции также называют нитроальдольной реакцией (нитроалкан, альдегид и спирт). Она почти аналогична альдольной реакции , которая была открыта 23 годами ранее и которая соединяет два карбонильных соединения с образованием β-гидроксикарбонильных соединений, известных как «альдоли» (альдегид и спирт). [2] [4] Реакция Генри — полезный метод в области органической химии из-за синтетической полезности ее соответствующих продуктов, поскольку их можно легко преобразовать в другие полезные синтетические промежуточные продукты. Эти превращения включают последующую дегидратацию с образованием нитроалкенов , окисление вторичного спирта с образованием α-нитрокетонов или восстановление нитрогруппы с образованием β-аминоспиртов.

Многие из этих применений были продемонстрированы в синтезах различных фармацевтических препаратов, включая β-блокатор ( S )-пропранолол , [5] [6] ингибитор протеазы ВИЧ Ампренавир (Vertex 478) и конструкцию углеводной субъединицы антибиотиков класса антрациклинов, L-акозамина. [6] Синтетическая схема синтеза L-акозамина приведена в разделе «Примеры» данной статьи.
Реакция Генри начинается с депротонирования нитроалкана в положении α-углерода, образуя нитронат . Значение pKa большинства нитроалканов составляет приблизительно 17. [7] [8] Хотя эта структура является нуклеофильной как в депротонированном углероде, так и в оксианионах нитрогруппы, [9] наблюдаемый результат заключается в том, что углерод атакует карбонильное соединение. Полученный β-нитроалкоксид протонируется сопряженной кислотой основания, которое первоначально депротонировало нитроалкильную структуру, давая соответствующий β-нитроспирт в качестве продукта.

Важно отметить, что все этапы реакции Генри обратимы. Это связано с отсутствием фиксированного этапа в реакции для образования продукта. Именно по этой причине исследования были направлены на модификации, чтобы довести реакцию до завершения. [2] [3] Более подробную информацию об этом можно найти в разделе модификаций этой статьи.
Рисунок ниже иллюстрирует одну из общепринятых моделей стереоселекции без каких-либо изменений в реакции Генри. В этой модели стереоселективность регулируется размером групп R в модели (например, углеродной цепью), а также переходным состоянием, которое минимизирует диполь , ориентируя нитрогруппу и карбонильный кислород друг против друга (на противоположных сторонах молекулы). Группы R играют роль в переходном состоянии реакции Генри: чем больше группы R на каждом из субстратов, тем больше они будут стремиться ориентироваться вдали друг от друга (обычно это называют стерическими эффектами ). [3] [10]
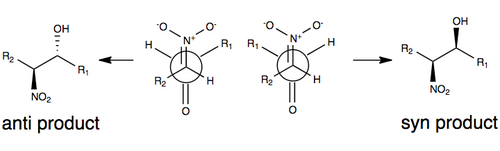
Из-за обратимости реакции и тенденции к легкой эпимеризации нитрозамещенного атома углерода (среди ряда факторов) реакция Генри обычно дает смесь энантиомеров или диастереомеров . Именно по этой причине объяснения стереоселективности остаются скудными без некоторой модификации реакции. [3] В последние годы фокус исследований сместился в сторону модификаций реакции Генри для преодоления этой синтетической проблемы.
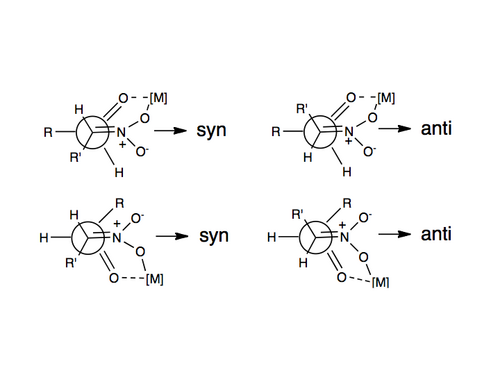
Первый пример энантиоселективной нитроальдольной реакции был описан в 1992 году с использованием катализаторов Шибасаки . [11] Одним из наиболее часто используемых методов индуцирования энантио- или диастереоселективности в реакции Генри является использование хиральных металлических катализаторов, в которых нитрогруппа и карбонильный кислород координируются с металлом, который связан с хиральной органической молекулой. Некоторые металлы, которые были использованы, включают цинк, кобальт, медь, магний и хром. [12] Изображение этой координации проиллюстрировано выше.
Одной из многих особенностей реакции Генри, делающей ее синтетически привлекательной, является то, что она использует только каталитическое количество основания для проведения реакции. Кроме того, можно использовать различные основания, включая ионные основания, такие как гидроксиды щелочных металлов, алкоксиды, карбонаты и источники фторид-аниона (например, TBAF) или неионные органические аминные основания, включая TMG, DBU, DBN и PAP. Важно отметить, что используемое основание и растворитель не оказывают большого влияния на общий результат реакции. [2]
Одним из главных недостатков реакции Генри является возможность побочных реакций на всем протяжении. Помимо присущей реакции обратимости (или «ретро-Генри»), которая может помешать протеканию реакции, β-нитроспирт также имеет потенциал для дегидратации. Для стерически затрудненных субстратов также возможно возникновение самоконденсации, катализируемой основанием ( реакция Канниццаро ). Общая схема реакции Канниццаро представлена ниже. [2]

В реакцию Генри был внесен ряд изменений. Наиболее важными из них являются использование высокого давления и иногда условий без растворителя для улучшения хемо- и региоселективности [2] и хиральных металлических катализаторов для индукции энантио- или диастереоселективности. [12] Реакция аза-Генри также используется для получения нитроаминов и может быть надежным синтетическим путем для синтеза вицинальных диаминов. [13]
Возможно, одной из наиболее синтетически полезных модификаций реакции Генри является использование органического катализатора . [2] [12] [14] Каталитический цикл показан ниже.

Бенджамин Лист описал, что хотя это широкое объяснение, его краткий обзор показывает, что это правдоподобное механистическое объяснение почти для всех реакций, в которых участвует органокатализатор. Пример такого типа реакции проиллюстрирован в разделе «Примеры» этой статьи.
В дополнение к ранее упомянутым модификациям реакции Генри существует множество других. Это включает в себя преобразование нереакционноспособных алкилнитросоединений в соответствующие им дианионы, которые будут реагировать быстрее с карбонильными субстратами, реакции могут быть ускорены с использованием PAP в качестве основания, использование реакционной способности альдегидов с α,α-дважды депротонированными нитроалканами для получения нитронатных алкоксидов, которые дают в основном син-нитроспирты после протонирования, и, наконец, генерация нитронатных анионов, в которых один атом кислорода в нитрогруппе защищен силилом для получения анти-β-нитроспиртов в присутствии источника фторидного аниона при реакции с альдегидом. [2] [3]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )