
Репарация несоответствий ДНК ( MMR ) — это система распознавания и исправления ошибочных вставок, делеций и неправильного включения оснований , которые могут возникнуть во время репликации и рекомбинации ДНК , а также исправления некоторых форм повреждений ДНК . [1] [2]
Репарация несоответствий является специфичной для цепи. Во время синтеза ДНК вновь синтезированная (дочерняя) цепь обычно будет включать ошибки. Чтобы начать репарацию, механизм репарации несоответствий отличает вновь синтезированную цепь от шаблона (родительской). У грамотрицательных бактерий временное гемиметилирование различает цепи (родительская метилирована , а дочерняя — нет). Однако у других прокариот и эукариот точный механизм не ясен. Предполагается, что у эукариот вновь синтезированная ДНК с отстающей цепью временно содержит зазубрины (до того, как будет запечатана ДНК-лигазой) и подает сигнал, который направляет системы проверки несоответствий на соответствующую цепь. Это подразумевает, что эти зазубрины должны присутствовать в ведущей цепи, и недавно были найдены доказательства этого. [3] Недавние исследования [4] показали, что разрывы являются сайтами для RFC-зависимой загрузки скользящего зажима репликации, ядерного антигена пролиферирующих клеток (PCNA), в ориентационно-специфической манере, так что одна сторона белка в форме пончика сопоставляется с концом 3'-OH в разрыве. Затем загруженный PCNA направляет действие эндонуклеазы MutLalpha [5] на дочернюю цепь в присутствии несоответствия и MutSalpha или MutSbeta.
Любое мутационное событие, нарушающее суперспиральную структуру ДНК , несет в себе потенциальную угрозу генетической стабильности клетки. Тот факт, что системы обнаружения и восстановления повреждений столь же сложны, как и сам механизм репликации, подчеркивает важность, которую эволюция придавала точности ДНК.
Примерами несовпадающих оснований являются пары G/T или A/C (см. Репарация ДНК ). Несовпадения обычно возникают из-за таутомеризации оснований во время репликации ДНК. Повреждение устраняется путем распознавания деформации, вызванной несовпадением, определения шаблонной и нешаблонной цепи, а также вырезания неправильно включенного основания и замены его правильным нуклеотидом . Процесс удаления включает в себя не только сам несовпадающий нуклеотид. Можно удалить несколько или до тысяч пар оснований вновь синтезированной цепи ДНК.
Репарация несоответствий — это высококонсервативный процесс от прокариот до эукариот . Первые доказательства репарации несоответствий были получены от S. pneumoniae ( гены hexA и hexB ). Последующие исследования E. coli выявили ряд генов, которые при мутационной инактивации вызывают гипермутабельные штаммы. Продукты генов, таким образом, называются белками «Mut» и являются основными активными компонентами системы репарации несоответствий. Три из этих белков необходимы для обнаружения несоответствия и направления к нему механизма репарации: MutS , MutH и MutL (MutS является гомологом HexA, а MutL — HexB).
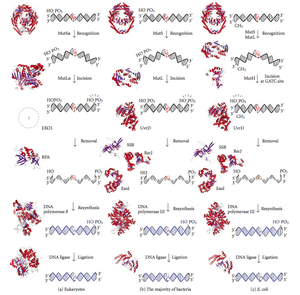
MutS образует димер (MutS 2 ), который распознает несовпадающее основание на дочерней цепи и связывает мутированную ДНК. MutH связывается с полуметилированными сайтами вдоль дочерней ДНК, но его действие латентно, активируясь только при контакте с димером MutL (MutL 2 ), который связывает комплекс MutS-ДНК и действует как посредник между MutS 2 и MutH, активируя последний. ДНК вытягивается для поиска ближайшего к несовпадению сайта метилирования d(GATC), который может находиться на расстоянии до 1 кб. После активации комплексом MutS-ДНК MutH разрезает дочернюю цепь около полуметилированного сайта. MutL привлекает геликазу UvrD (ДНК-хеликазу II) для разделения двух цепей с определенной полярностью от 3' до 5'. Затем весь комплекс MutSHL скользит вдоль ДНК в направлении несоответствия, освобождая цепь для вырезания по мере ее продвижения. Экзонуклеаза следует за комплексом и переваривает одноцепочечный ДНК-хвост. Привлеченная экзонуклеаза зависит от того, с какой стороны несоответствия MutH разрезает цепь – с 5' или 3'. Если надрез, сделанный MutH, находится на 5' конце несоответствия, используется либо RecJ, либо ExoVII (обе экзонуклеазы 5' на 3'). Однако если надрез находится на 3' конце несоответствия, используется ExoI (фермент 3' на 5').
Весь процесс заканчивается после места несоответствия, то есть и сам сайт, и окружающие его нуклеотиды полностью вырезаются. Одноцепочечный разрыв, созданный экзонуклеазой, затем может быть восстановлен ДНК-полимеразой III (при содействии белка, связывающего одноцепочечную ДНК), которая использует другую цепь в качестве шаблона, и, наконец, запечатывается ДНК-лигазой. Затем ДНК-метилаза быстро метилирует дочернюю цепь.
При связывании димер MutS 2 изгибает спираль ДНК и защищает около 20 пар оснований. Он обладает слабой АТФазной активностью, а связывание АТФ приводит к образованию третичных структур на поверхности молекулы. Кристаллическая структура MutS показывает, что он исключительно асимметричен, и, хотя его активная конформация представляет собой димер, только одна из двух половин взаимодействует с сайтом несоответствия.
У эукариот M ut S h omologs образуют два основных гетеродимера: Msh2 /Msh6 (MutSα) и Msh2 /Msh3 (MutSβ). Путь MutSα участвует в основном в замене оснований и репарации несоответствий малых петель. Путь MutSβ также участвует в репарации малых петель, в дополнение к репарации больших петель (~10 нуклеотидных петель). Однако MutSβ не восстанавливает замены оснований.
MutL также имеет слабую активность АТФазы (использует АТФ для движения). Он образует комплекс с MutS и MutH, увеличивая след MutS на ДНК.
Однако процессивность (расстояние, которое фермент может пройти вдоль ДНК до диссоциации) UvrD составляет всего ~40–50 п.н. Поскольку расстояние между надрезом, созданным MutH, и несоответствием может составлять в среднем ~600 п.н., если нет другого загруженного UvrD, раскрученный участок может свободно повторно отжигаться со своей комплементарной цепью, заставляя процесс начинаться заново. Однако при содействии MutL скорость загрузки UvrD значительно увеличивается. В то время как процессивность (и использование АТФ) отдельных молекул UvrD остается прежней, общий эффект на ДНК значительно усиливается; у ДНК нет возможности повторно отжигаться, поскольку каждый UvrD раскручивает 40–50 п.н. ДНК, диссоциирует, а затем немедленно заменяется другим UvrD, повторяя процесс. Это подвергает большие участки ДНК экзонуклеазному расщеплению, что позволяет быстро удалить (и впоследствии заменить) неправильную ДНК.
Эукариоты имеют пять гомологов M ut L, обозначенных как MLH1, MLH2, MLH3, PMS1 и PMS2. Они образуют гетеродимеры, которые имитируют MutL в E. coli . Человеческие гомологи прокариотического MutL образуют три комплекса, называемые MutLα, MutLβ и MutLγ. Комплекс MutLα состоит из субъединиц MLH1 и PMS2, гетеродимер MutLβ состоит из MLH1 и PMS1, тогда как MutLγ состоит из MLH1 и MLH3. MutLα действует как эндонуклеаза, которая вносит разрывы нитей в дочернюю цепь при активации несоответствиями и другими необходимыми белками, MutSα и PCNA. Эти разрывы нитей служат точками входа для экзонуклеазной активности, которая удаляет несоответствующую ДНК. Роль MutLβ и MutLγ в репарации ошибочно спаренных оснований изучена меньше.
MutH — очень слабая эндонуклеаза , которая активируется после связывания с MutL (который сам связан с MutS). Она разрезает неметилированную ДНК и неметилированную цепь полуметилированной ДНК, но не разрезает полностью метилированную ДНК. Эксперименты показали, что репарация несоответствий является случайной, если ни одна из цепей не метилирована. [ необходима цитата ] Такое поведение привело к предположению, что MutH определяет, какая цепь содержит несоответствие. У MutH нет эукариотического гомолога. Его эндонуклеазную функцию берут на себя гомологи MutL, которые обладают некоторой специализированной 5'-3' экзонуклеазной активностью. Смещение цепи для удаления несоответствий из недавно синтезированной дочерней цепи у эукариот может быть обеспечено свободными 3' концами фрагментов Оказаки в новой цепи, созданной во время репликации.
PCNA и β-скользящий зажим ассоциируются с MutSα/β и MutL соответственно. Хотя первоначальные отчеты предполагали, что комплекс PCNA-MutSα может усиливать распознавание несоответствий, [6] недавно было продемонстрировано [7] , что не наблюдается явных изменений в сродстве MutSα к несоответствию в присутствии или отсутствии PCNA. Более того, мутанты MutSα, которые не способны взаимодействовать с PCNA in vitro, демонстрируют способность выполнять распознавание несоответствий и вырезание несоответствий до уровней, близких к дикому типу. Такие мутанты дефектны в реакции репарации, направляемой разрывом 5'-цепи, что впервые предполагает функцию MutSα на этапе пост-эксцизии реакции.
Мутации в человеческих гомологах белков Mut влияют на геномную стабильность, что может привести к микросателлитной нестабильности (MSI), связанной с некоторыми видами рака у человека. В частности, наследственные неполипозные колоректальные раки ( HNPCC или синдром Линча) приписываются повреждающим вариантам зародышевой линии в генах, кодирующих гомологи MutS и MutL MSH2 и MLH1 соответственно, которые, таким образом, классифицируются как гены-супрессоры опухолей. Один подтип HNPCC, синдром Мьюира-Торре (MTS), связан с опухолями кожи. Если обе унаследованные копии (аллели) гена MMR несут повреждающие генетические варианты, это приводит к очень редкому и тяжелому состоянию: синдрому рака с несоответствием (или конституционному дефициту несоответствия, CMMR-D), проявляющемуся в виде множественных случаев опухолей в раннем возрасте, часто опухолей толстой кишки и головного мозга . [8]
Спорадические виды рака с дефицитом репарации ДНК редко имеют мутацию в гене репарации ДНК, но вместо этого они, как правило, имеют эпигенетические изменения, такие как метилирование промотора, которое подавляет экспрессию гена репарации ДНК. [9] Около 13% случаев колоректального рака имеют дефицит репарации несоответствий ДНК, обычно из-за потери MLH1 (9,8%), или иногда MSH2, MSH6 или PMS2 (все ≤1,5%). [10] Для большинства спорадических видов колоректального рака с дефицитом MLH1 дефицит был вызван метилированием промотора MLH1. [10] Другие типы рака имеют более высокие частоты потери MLH1 (см. таблицу ниже), что снова в значительной степени является результатом метилирования промотора гена MLH1 . Другой эпигенетический механизм, лежащий в основе дефицитов MMR, может включать сверхэкспрессию микроРНК, например, уровни miR-155 обратно коррелируют с экспрессией MLH1 или MSH2 при колоректальном раке. [11]
Дефект поля (канцеризация поля) — это область эпителия, которая была предварительно обусловлена эпигенетическими или генетическими изменениями, предрасполагающими ее к развитию рака. Как указал Рубин, «...есть доказательства того, что более 80% соматических мутаций, обнаруженных в человеческих колоректальных опухолях с фенотипом мутатора, происходят до начала терминальной клональной экспансии». [20] [21] Аналогичным образом, Фогельштейн и др. [22] отмечают, что более половины соматических мутаций, обнаруженных в опухолях, произошли в преднеопластической фазе (в дефекте поля), во время роста, по-видимому, нормальных клеток.
Дефициты MLH1 были распространены в полевых дефектах (гистологически нормальных тканях), окружающих опухоли; см. таблицу выше. Эпигенетически подавленный или мутировавший MLH1, вероятно, не даст селективного преимущества стволовой клетке, однако он вызовет повышенную частоту мутаций, и один или несколько мутировавших генов могут предоставить клетке селективное преимущество. Дефицитный ген MLH1 затем может переноситься как селективно почти нейтральный пассажирский ген (попутчик), когда мутировавшая стволовая клетка генерирует расширенный клон. Продолжающееся присутствие клона с эпигенетически подавленным MLH1 будет продолжать генерировать дальнейшие мутации, некоторые из которых могут привести к опухоли.
Первоначально было обнаружено, что мутации MMR и репарации несоответствий связаны с эффективностью блокады иммунных контрольных точек в исследовании, изучающем пациентов, ответивших на анти-PD1. [23] Связь между положительным результатом MSI и положительным ответом на анти-PD1 была впоследствии подтверждена в проспективном клиническом исследовании и одобрена FDA. [24]
У людей семь белков репарации несоответствий ДНК (MMR) ( MLH1 , MLH3 , MSH2 , MSH3 , MSH6 , PMS1 и PMS2 ) работают согласованно на последовательных этапах, инициируя репарацию несоответствий ДНК. [25] Кроме того, существуют Exo1 -зависимые и Exo1-независимые подпути MMR. [26]
Другие генные продукты, участвующие в репарации несоответствий (после инициации генами MMR) у людей, включают ДНК-полимеразу дельта , PCNA , RPA , HMGB1 , RFC и ДНК-лигазу I , а также факторы, модифицирующие гистоны и хроматин . [27] [28]
При определенных обстоятельствах путь MMR может задействовать склонную к ошибкам ДНК-полимеразу eta ( POLH ). Это происходит в B-лимфоцитах во время соматической гипермутации , где POLH используется для введения генетической изменчивости в гены антител. [29] Однако этот склонный к ошибкам путь MMR может быть запущен в других типах клеток человека при воздействии генотоксинов [30] и, действительно, он широко активен при различных видах рака у человека, вызывая мутации, которые несут на себе след активности POLH. [31]
Распознавание и исправление несоответствий и инделей важно для клеток, поскольку неспособность сделать это приводит к микросателлитной нестабильности (MSI) и повышенной частоте спонтанных мутаций (мутаторный фенотип). По сравнению с другими типами рака, рак с дефицитом MMR (MSI) имеет очень высокую частоту мутаций, близкую к меланоме и раку легких [32] , типам рака, вызванным значительным воздействием УФ-излучения и мутагенных химических веществ.
Помимо очень высокого бремени мутаций, дефицит MMR приводит к необычному распределению соматических мутаций по всему геному человека: это говорит о том, что MMR преимущественно защищает богатые генами, рано реплицирующиеся эухроматиновые регионы. [33] Напротив, бедные генами, поздно реплицирующиеся гетерохроматиновые регионы генома демонстрируют высокие показатели мутаций во многих опухолях человека. [34]
Гистоновая модификация H3K36me3 , эпигенетическая метка активного хроматина, обладает способностью рекрутировать комплекс MSH2-MSH6 (hMutSα). [35] Соответственно, области человеческого генома с высоким уровнем H3K36me3 накапливают меньше мутаций из-за активности MMR. [31]
Отсутствие MMR часто происходит в координации с потерей других генов репарации ДНК. [9] Например, гены MMR MLH1 и MLH3, а также 11 других генов репарации ДНК (такие как MGMT и многие гены пути NER ) были значительно подавлены как в астроцитомах низкой, так и высокой степени злокачественности , в отличие от нормальной ткани мозга. [36] Более того, экспрессия MLH1 и MGMT была тесно связана в 135 образцах рака желудка, а потеря MLH1 и MGMT, по-видимому, синхронно ускорялась во время прогрессирования опухоли. [37]
Недостаточная экспрессия нескольких генов репарации ДНК часто встречается при раковых заболеваниях [9] и может способствовать появлению тысяч мутаций, обычно обнаруживаемых при раковых заболеваниях (см. Частота мутаций при раковых заболеваниях ).
Популярная идея, которая не получила существенной экспериментальной поддержки, заключается в том, что мутация, в отличие от повреждения ДНК, является основной причиной старения. У мышей с дефектом гомолога mutL Pms2 частота мутаций во всех тканях примерно в 100 раз выше, но они, по-видимому, не стареют быстрее. [38] Эти мыши демонстрируют в основном нормальное развитие и жизнь, за исключением раннего начала канцерогенеза и мужского бесплодия.
{{cite book}}: |journal=проигнорировано ( помощь )