Рецептор липопротеинов очень низкой плотности ( VLDLR ) является трансмембранным рецептором липопротеинов из семейства рецепторов липопротеинов низкой плотности (ЛПНП) . VLDLR демонстрирует значительную гомологию с членами этой линии. Открытый в 1992 году Т. Ямамото, VLDLR широко распространен во всех тканях организма, включая сердце, скелетные мышцы , жировую ткань и мозг, но отсутствует в печени. [5] Этот рецептор играет важную роль в поглощении холестерина, метаболизме липопротеинов, содержащих аполипопротеин E , богатых триацилглицерином , и миграции нейронов в развивающемся мозге. У людей VLDLR кодируется геном VLDLR . Мутации этого гена могут приводить к различным симптомам и заболеваниям, которые включают лиссэнцефалию I типа , гипоплазию мозжечка и атеросклероз .
VLDLR является членом семейства рецепторов липопротеинов низкой плотности (ЛПНП) , которое полностью состоит из трансмембранных липопротеиновых рецепторов I типа.
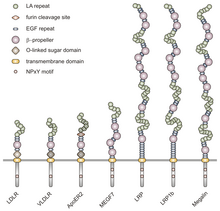
Все члены этого семейства разделяют пять высококонсервативных структурных доменов: внеклеточный N-концевой лиганд- связывающий домен с богатыми цистеином повторами (также называемыми лиганд-связывающими повторами), эпидермальный фактор роста (EGF), домен O-связанного гликозилирования сахара, единственную трансмембранную последовательность и цитоплазматический домен, который содержит последовательность NPxY. Мотив NPxY функционирует в передаче сигнала и нацеливании рецепторов на покрытые ямки и состоит из последовательности аспарагин-пролин-X-тирозин, где X может быть любой аминокислотой. [6] Подражая этой общей структуре, VLDLR имеет восемь, 40 аминокислот длиной цистеиновых повторов, богатых в своем внеклеточном N-концевом лиганд-связывающем домене. [6] Это главное отличие от основного члена семейства рецепторов ЛПНП, LDLR , который имеет только семь богатых цистеином повторов, которые также имеют длину 40 аминокислот. [7] Каждый из этих цистеин-богатых повторов, как в VLDLR, так и в LDLR, имеет три дисульфидные связи и координированный ион Ca2 + . N-конец также состоит из остатка глицина, за которым следуют 27 гидрофобных остатков, которые составляют сигнальный пептид . [6] После этого региона находится повтор EGF, сегмент β-пропеллера , который играет роль в pH-зависимой диссоциации комплекса лиганд-рецептор, [8] и еще два повтора EGF. [9] Следующий в последовательности домен гликозилирования VLDLR O-связанного типа имеет много остатков треонина и серина и насчитывает в общей сложности 46 аминокислот. Трансмембранный домен, который функционирует в закреплении рецепторов на мембране, имеет длину 22 аминокислоты. [6] Последним в последовательности является цитоплазматический домен из 54 аминокислот, который содержит мотив NPxY. [8]
Полноразмерный геном VLDLR человека расположен в локусе 9p24 на хромосоме 9. Он состоит из сегмента 40 кб, который включает 19 экзон -кодирующих последовательностей, что на один экзон больше, чем кодируется LDLR . Этот дополнительный экзон в гене VLDLR объясняет дополнительный цистеин-связывающий повтор, не обнаруженный в LDLR. [7] Вместе экзоны, составляющие ген VLDLR, кодируют белок длиной 873 аминокислотных остатка. Известно, что VLDLR существует в виде четырех различных изоформ белка : типа I, II, III и IV. Эти различные изоформы являются результатом вариаций альтернативного сплайсинга . Транскрипт VLDLR типа I (VLDLR-I) состоит из всех 19 экзонов. С другой стороны, в VLDLR-II отсутствует экзон 16, который кодирует домен O-гликозилирования между сахарными областями. VLDLR-III не имеет экзона 4, который кодирует третий лиганд -связывающий повтор. Наконец, транскрипты VLDLR-IV не имеют как экзона 16, так и экзона 4. Было показано, что 75% транскриптов VLDLR существуют как изоформа типа II в моделях мозга мышей . Это показывает, что большинство VLDLR в мозге не гликозилированы, так как тип II не имеет экзона 16, который кодирует домен O-гликозилирования. Изоформа типа IV, как известно, является второй по значимости. [6]
В семействе рецепторов ЛПНП наблюдается высокий уровень консерватизма . В частности, общая гомология последовательностей между VLDLR и ApoER2 , другим липопротеиновым рецептором этого семейства, составляет 50%. [6] Сравнивая LDLR и VLDLR, было обнаружено, что их первичные структуры на 55% идентичны в пределах их лиганд -связывающих областей. Модульные структуры этих двух белков практически накладываются друг на друга, единственным отличием является дополнительный богатый цистеином повтор в VLDLR. Это демонстрируется посредством выравнивания двух рецепторов в соответствии с их линкерной областью; в LDLR линкерная область расположена между богатыми цистеином повторами четвертым и пятым из его семи повторов, тогда как в VLDLR линкерная область, по-видимому, находится между повторами пятым и шестым из его восьми повторов. [10]
VLDLR также показывает высокую гомологию среди различных видов. VLDLR людей, мышей, крыс и кроликов были идентифицированы как на 95% идентичные. Кроме того, существует приблизительно 84% сохранения с соответствующим белком у кур. Этот уровень гомологии между видами намного выше, чем тот, который был обнаружен для LDLR. Следовательно, эти сравнения генов предполагают, что VLDLR и LDLR разошлись до того, как LDLR разошлись среди позвоночных. [10]
VLDLR связывает соединения, содержащие аполипопротеин E (apoE). Эти лиганды прикрепляются к цистеин-связывающим повторам на N-конце. Различия в цистеин-богатых повторах между членами семейства рецепторов LDL приводят к различиям в сродстве связывания. VLDLR, в частности, связывает VLDL и липопротеины промежуточной плотности (IDL), но не LDL . Эта неспособность связывать LDL обусловлена неспособностью VLDLR связывать аполипопротеин B (apoB), который присутствует в LDL. [11]
Рецептор-ассоциированный белок (RAP) и тромбоспондин-1 (THBS1) были идентифицированы как соединения, которые связывают VLDLR. Во многих случаях эти соединения проявляют ингибирующее действие. THBS1 связывает VLDLR и блокирует связывание лиганда. [11] Это играет важную роль в пути рилина , поскольку THBS1 может блокировать присоединение рилина, одновременно стимулируя факторы транскрипции , обычно активируемые рилином. Однако это связывание THBS1 не вызывает последующую деградацию этих факторов транскрипции, как это делает рилин, и, таким образом, может привести к значительно усиленным эффектам. [6] Белок RAP действует аналогичным образом, блокируя связывание рилина с VLDLR. Однако в этом случае фосфорилирование факторов транскрипции, обычно выполняемое рилином, также блокируется. [12]
VLDLR обнаруживается по всему телу, с особенно высокой экспрессией в тканях жирных кислот из-за их высокого уровня триглицеридов , основного лиганда VLDLR. Эти ткани включают ткани сердца, скелетных мышц и жирового слоя . Кроме того, рецептор обнаруживается в макрофагах, эндотелиальных клетках капилляров [8] и в мозге, где он имеет совершенно иную функцию, чем та, которая обнаруживается в остальной части тела. Существует предпочтительная экспрессия для VLDLR типа I в сердце, скелетных мышцах и мозге, в отличие от типа II, который в основном экспрессируется в немышечных тканях, включая большой мозг , мозжечок , почки, селезенку и эндотелиальные клетки аорты. [7] [11] Самая высокая экспрессия VLDLR обнаруживается в мозге. Хотя VLDLR обнаруживается почти во всех областях мозга, его самая высокая экспрессия ограничена корой и мозжечком. Здесь рецептор может быть обнаружен на покоящейся или активированной микроглии , которая связана с сенильными бляшками и корковыми нейронами, нейробластами , матричными клетками, клетками Кахаля-Ретциуса , глиобластами , астроцитами , олигодендроцитами и пирамидальными нейронами , специфичными для определенных регионов . [6] Несмотря на свою важную роль в метаболизме холестерина и жирных кислот, VLDLR не обнаружен в печени. Это явление в основном объясняется очень высокими уровнями LDLR в этих областях. [7] Кроме того, было обнаружено, что этот рецептор обнаружен субклеточно в нелипидных плотовых участках клеточных мембран. [6]
В отличие от LDLR , VLDLR не проявляет никакого механизма обратной связи, и, следовательно, внутриклеточные липопротеины не способны регулировать его. Это явление обусловлено различием в стерол -регуляторном элементе-1 (SRE-1) VLDLR. Нормальные последовательности SRE-1, подобные тем, что обнаружены в LDLR, характеризуются двумя повторами кодона CAC, разделенными двумя промежуточными нуклеотидами C (5'-CACCCCAC-3'). Связывающий белок стерол-регуляторного элемента -1 (SREBP-1), фактор транскрипции , нацеливается на повторы CAC SRE-1 для регуляции транскрипции белка. Однако ген VLDLR кодируется двумя последовательностями, подобными SRE-1, которые содержат однонуклеотидные полиморфизмы . Эти полиморфизмы нарушают связывание SREBP-1 с повторами CAC и, следовательно, устраняют механизм обратной связи, наблюдаемый в других белках. [7]
Экспрессия VLDLR регулируется рецептором-гамма, активируемым пролифератором пероксисом (PPAR-γ). Исследование 2010 года показало, что рецептурный препарат Пиоглитазон , агонист PPAR-γ, увеличивает экспрессию мРНК VLDLR и уровни белка в экспериментах с использованием фибробластов мышей. Мыши, получавшие лечение Пиоглитазоном, показали более высокую скорость преобразования триглицеридов плазмы в эпидидимальные жиры. Как и ожидалось, мыши с дефицитом VLDLR не показали такой же реакции. [8] Эти результаты свидетельствуют о том, что VLDLR важен для накопления жира. [8]
Многие другие гормоны и диетические факторы также регулируют экспрессию VLDLR. Тиреоидный гормон положительно регулирует экспрессию VLDLR в скелетных мышцах крыс, но не в жировой или сердечной тканях. У кроликов экспрессия VLDLR в сердечной мышце повышается эстрогеном и понижается фактором, стимулирующим колонии гранулоцитов-макрофагов . В клеточных линиях, полученных из трофобласта , повышенная регуляция экспрессии VLDLR происходит, когда клетки инкубируются с гиполипидемическими агентами, такими как инсулин и клофибрат . Напротив, 8-бромаденозин 3',5'-циклический монофосфат (8-бром-цАМФ) понижает экспрессию VLDLR. Наконец, на VLDLR влияет присутствие апоЕ и LDLR. Присутствие апоЕ необходимо для регуляции экспрессии VLDLR, в то время как отсутствие LDLR изменяет последовательности VLDLR, подобные стерол -регуляторному элементу 1, делая их функциональными только в сердечной и скелетной мышцах. [7]
VLDLR — это периферический липопротеиновый рецептор, который функционирует в метаболизме липопротеинов, сердечном метаболизме жирных кислот и отложении жира. По сути, VLDLR позволяет холестерину достигать тканей из кровотока, где он может использоваться в клеточных мембранах. Кроме того, он позволяет жирным кислотам попадать в клетки, где они могут использоваться в качестве источника энергии. [7] В целом, VLDLR в первую очередь модулирует внепеченочный метаболизм липопротеинов, богатых триглицеридами . [8]
VLDLR играет только дискретную роль в метаболизме липидов, но более значима в стрессовых ситуациях. У мышей с двойными нокаутами в VLDLR и LDLR уровень триглицеридов в сыворотке выше , чем у мышей с нокаутом только в гене LDLR . Кроме того, у мышей с нокаутом LDLR и сверхэкспрессией VLDLR уровень триглицеридов в сыворотке снижен. Хотя отложение жира близко к нормальному без VLDLR, его роль становится важной при дефиците LDLR. Несмотря на эти знания о его роли в поглощении липопротеинов, полный механизм метаболизма липидов, выполняемый VLDLR, до конца не изучен. [11]
Известно, что VLDLR использует эндоцитоз , хотя точный механизм этого процесса для этого белка неизвестен. Эндоцитоз опосредован последовательностями NPxY, которые, как известно, подают сигнал для интернализации рецептора через покрытые клатрином ямки . Наличие этой последовательности в цитоплазматическом хвосте VLDLR делает эндоцитоз возможным. [11] В целом, липопротеиновые рецепторы подвергаются процессу, посредством которого они эндоцитируются со своим лигандом в покрытые клатрином ямки. Отсюда они вместе транспортируются в ранние и поздние эндосомы , пока не достигнут лизосомы . В этот момент происходит гидролиз, и липопротеин высвобождается в цитоплазму, в то время как рецепторы возвращаются на поверхность клетки. Пока не подтверждено, следует ли VLDLR этому точному механизму, но один из тесно связанных с ним, вероятно, существует. [8]

В дополнение к своей роли во всем теле, VLDLR играет уникальную роль в мозге. Это ключевой компонент пути рилина , который функционирует, с одной стороны, в миграции нейронов во время развития мозга, с другой стороны, в сохранении новых следов памяти в гиппокампальной формации . [13] [14] VLDLR связывает белок рилина с внутриклеточным сигнальным белком Dab1 , который сообщает отдельным нейронам, куда им идти в пределах анатомии мозга. Мутации в VLDLR часто не приводят к серьезной дезорганизации, как это наблюдается при мутациях рилина. Однако мутация VLDLR приводит к некоторой дезорганизации, в первую очередь локализованной в мозжечке , где VLDLR, как полагают, наиболее заметен. [6]
VLDLR экспрессируется на мигрирующих нейронах, чтобы помочь им занять правильное место в мозге. Этот процесс является частью пути рилина , который отвечает за формирование изнутри наружу шестислойного неокортекса . [6] Несмотря на открытие этого пути, многие особенности и молекулярные механизмы этого процесса все еще обсуждаются. Наличие двух рецепторов рилина, VLDLR и ApoER2 , затруднило различение специфической функции каждого белка. [15]

VLDLR в первую очередь отвечает за правильное наслоение пирамидальных клеток в слое 1 коры головного мозга . В частности, отсутствие VLDLR может привести к эктопическому накоплению пирамидальных клеток в этой области. [15] VLDLR не влияет на миграцию рано рожденных клеток в организованный слой, но поскольку его отсутствие приводит к вторжению этих нейробластов в краевую зону, предполагается, что VLDLR может кодировать «стоп-сигнал». Это подтверждается тем фактом, что VLDLR в первую очередь экспрессируется в корковой пластинке, прилегающей к клеткам, экспрессирующим рилин, клеткам Кахаля-Ретциуса , и в промежуточной зоне. Однако окончательных доказательств пока не найдено. [6] В целом, рилин связывает VLDLR и подвергается эндоцитозу через покрытые клатрином везикулы . [6] Между тем, внутриклеточный белок Dab1 имеет домен PI/PTB , который взаимодействует с последовательностью NPxY, обнаруженной в цитоплазматическом хвосте VLDLR. [12] В результате Dab1 фосфорилируется по тирозину, а рилин деградирует. Наконец, фосфорилированный Dab1 активирует внутриклеточный сигнальный каскад, который направляет нейробласты в их правильное место через изменение цитоскелета . [ 12] [16] Многие особенности этого пути все еще изучаются. Пока неизвестно, фосфорилируется ли Dab1 в результате эндоцитоза рилина или есть другой механизм. Помимо организации неокортекса, VLDLR также играет роль в миграции нейронов гиппокампа и клеток Пуркинье мозжечка . Тем не менее, большая часть информации об этом процессе все еще неизвестна. [6]
Мутации в гене VLDLR приводят к множеству расстройств различной степени тяжести. Эти расстройства обычно связаны с гомеостазом холестерина или дезорганизацией упорядочения нейронов в мозге из-за нарушения пути рилина . Наиболее известными из этих заболеваний являются лиссэнцефалия I типа , гипоплазия мозжечка, связанная с VLDR , и атеросклероз . В отличие от того, чтобы вызывать заболевания, VLDLR также был идентифицирован как возможное средство от некоторых расстройств. Внедрение VLDLR в печень может вылечить семейную гиперхолестеринемию (FH) у пациентов, которые либо имеют дефектный LDLR , либо имеют дефектную иммунную систему, которая атакует этот белок. Поскольку VLDLR неиммуногенен, он не инициирует иммунный ответ, поэтому он может нормально функционировать при дефектной иммунной системе. [7] Кроме того, поскольку апоЕ , основной лиганд VLDLR, является ведущим генетическим фактором риска болезни Альцгеймера , VLDLR может играть роль в регуляции риска этого расстройства [6] , что объясняется тем фактом, что снижение сигнализации рилина в зубчатой фасции , как предполагается, инициирует болезнь Альцгеймера. [17] Также было показано, что VLDLR снижает вероятность преждевременных сердечных заболеваний и инсульта, поскольку VLDLR выводит липопротеин А (Lp(a)), основной наследственный фактор риска этих заболеваний. [7]
Лиссэнцефалия I типа , или агирия-пахигирия, является редким нарушением развития, характеризующимся отсутствием извилин и борозд в мозге. Эти тяжелые пороки развития являются результатом аберрантной миграции нейронов . При классической лиссэнцефалии I типа миграция нейронов начинается, но не может продолжаться до конца. Этот процесс, вероятно, нарушается изменениями в нескольких генах, включая VLDLR , DCX , ARX , TUBA1A , RELN и LIS1 . Таким образом, тяжесть лиссэнцефалии I типа варьируется в зависимости от типа мутации. Гомозиготная делеция, затрагивающая ген VLDLR, приводит к низкой степени утолщения коры и отсутствию зоны разреженных клеток. Зона разреженных клеток описывает область между внешним и внутренним слоями коры арестованных нейронов. [18] Кроме того, лиссэнцефалия 1 типа тесно связана с гипоплазией мозжечка .
Синдром неравновесия (DES) был впервые описан в 1970-х годах как непрогрессирующее неврологическое расстройство. [19] В исследовании 2005 года DES был переименован в VLDLR-ассоциированную мозжечковую гипоплазию (VLDLRCH) после того, как ее причина была связана с нарушением в гене VLDLR . [20] Было идентифицировано по крайней мере шесть мутаций, влияющих на гомозиготный рецессивный аллель гена VLDLR , и было обнаружено, что они вызывают VLDLRCH. Несколько из этих мутаций были локализованы в определенных экзонах, кодирующих ген. Одной из таких мутаций является переход цитозина в тимин в паре оснований 1342 в экзоне 10, который вызывает замену в Arg 448 на сигнал терминации . Аналогичным образом, есть доказательства перехода цитозина в тимин в паре оснований номер 769 в экзоне 5, который вызывает замену в Arg 257 на сигнал терминации. Третья известная мутация вызвана гомозиготной делецией 1-пары оснований в экзоне 17, которая вызывает сдвиг рамки считывания и преждевременное завершение в домене O-связанного сахара . [21] Все такие изменения в гене VLDLR предотвращают выработку VLDLR и поэтому называются мутациями потери функции. Признанными симптомами VLDLRCH являются умеренная или тяжелая умственная отсталость, судороги, дизартрия , косоглазие и задержка локомоции. В некоторых случаях дети с VLDLRCH учатся ходить очень поздно в развитии после шести лет или никогда не учатся ходить самостоятельно. Частота этого расстройства неизвестна, поскольку ранняя диагностика VLDLRCH затруднена с помощью методов визуализации. Оно связано с кровным родством родителей и встречается в изолированных общинах, таких как гуттериты и инбридинговые семьи из Ирана и Турции. [22]
Атеросклероз характеризуется чрезмерным накоплением холестерина макрофагами , что приводит к их трансформации в пенистые клетки . Это накопление холестерина вызвано нарушением регуляции притока и оттока холестерина. Поскольку макрофаги не обладают способностью ограничивать приток холестерина, баланс полностью зависит от путей оттока. VLDLR экспрессируется макрофагами и функционирует в поглощении собственных липопротеинов . Уникально, что VLDLR не реагирует на нагрузку холестерином, вероятно, из-за отсутствия у него механизмов обратной связи. Неспособность контролировать поглощение собственных липопротеинов делает VLDLR проатерогенным фактором. [23] Эта характеристика подтверждается результатами исследования 2005 года, в котором повторное введение VLDLR в мышей с нокаутом VLDLR привело к значительному увеличению развития атеросклеротических поражений. [23]