В биохимии рибонуклеотид — это нуклеотид, содержащий рибозу в качестве своего пентозного компонента. Он считается молекулярным предшественником нуклеиновых кислот . Нуклеотиды являются основными строительными блоками ДНК и РНК . Сами рибонуклеотиды являются основными мономерными строительными блоками для РНК. Дезоксирибонуклеотиды , образованные путем восстановления рибонуклеотидов ферментом рибонуклеотидредуктазой (РНР), являются важнейшими строительными блоками для ДНК. [1] Существует несколько различий между дезоксирибонуклеотидами ДНК и рибонуклеотидами РНК. Последовательные нуклеотиды связаны друг с другом посредством фосфодиэфирных связей.
Рибонуклеотиды также используются в других клеточных функциях. Эти специальные мономеры используются как в регуляции клеток, так и в клеточной сигнализации , как это видно на примере аденозинмонофосфата ( АМФ ). Кроме того, рибонуклеотиды могут быть преобразованы в аденозинтрифосфат ( АТФ ), энергетическую валюту в организмах. Рибонуклеотиды могут быть преобразованы в циклический аденозинмонофосфат ( циклический АМФ ) для регуляции гормонов в организмах. [1] В живых организмах наиболее распространенными основаниями для рибонуклеотидов являются аденин (A), гуанин (G), цитозин (C) или урацил (U). Азотистые основания подразделяются на два родительских соединения: пурин и пиримидин .


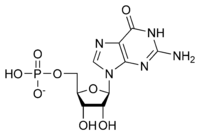


Общая структура рибонуклеотида состоит из фосфатной группы, рибозной сахарной группы и нуклеиновой основы, в которой нуклеиновая основа может быть аденином, гуанином, цитозином или урацилом. Без фосфатной группы состав нуклеиновой основы и сахара известен как нуклеозид. Взаимозаменяемые азотистые нуклеиновые основы получены из двух исходных соединений, пурина и пиримидина. Нуклеотиды являются гетероциклическими соединениями , то есть они содержат по крайней мере два различных химических элемента в качестве членов своих колец. [ необходима цитата ]
И РНК, и ДНК содержат два основных пуриновых основания, аденин (A) и гуанин (G), и два основных пиримидина. И в ДНК, и в РНК одним из пиримидинов является цитозин (C). Однако ДНК и РНК различаются по второму основному пиримидину. ДНК содержит тимин (T), а РНК содержит урацил (U). Существуют некоторые редкие случаи, когда тимин встречается в РНК, а урацил — в ДНК. [1]
Вот 4 основных рибонуклеотида (рибонуклеозид 5'-монофосфата), которые являются структурными единицами РНК.
В рибонуклеотидах сахарный компонент — рибоза, а в дезоксирибонуклеотидах сахарный компонент — дезоксирибоза. Вместо гидроксильной группы у второго углерода в кольце рибозы она заменена атомом водорода. [2]
Оба типа пентоз в ДНК и РНК находятся в форме β-фуранозы (закрытое пятичленное кольцо), и они определяют идентичность нуклеиновой кислоты. ДНК определяется содержанием 2'-дезоксирибозы нуклеиновой кислоты, тогда как РНК определяется содержанием рибозы нуклеиновой кислоты. [1]
В некоторых случаях ДНК и РНК могут содержать некоторые второстепенные основания. Метилированные формы основных оснований наиболее распространены в ДНК. В вирусной ДНК некоторые основания могут быть гидроксиметилированы или глюкозилированы. В РНК второстепенные или модифицированные основания встречаются чаще. Некоторые примеры включают гипоксантин, дигидроурацил, метилированные формы урацила, цитозина и гуанина, а также модифицированный нуклеозид псевдоуридин. [3] Также наблюдались нуклеотиды с фосфатными группами в положениях, отличных от 5' углерода. Примерами являются рибонуклеозид 2',3'-циклические монофосфаты, которые являются изолируемыми промежуточными продуктами, и рибонуклеозид 3'-монофосфаты, которые являются конечными продуктами гидролиза РНК определенными рибонуклеазами. Другие вариации включают аденозин 3',5'-циклический монофосфат (цАМФ) и гуанозин 3',5'-циклический монофосфат (цГМФ). [4]
Рибонуклеотиды связаны друг с другом, образуя цепи РНК, посредством фосфодиэфирных связей . 5'-фосфатная группа одного нуклеотида связана с 3'-гидроксильной группой следующего нуклеотида, создавая остов чередующихся остатков фосфата и пентозы. На каждом конце полинуклеотида нет фосфодиэфирной связи. [5] Фосфодиэфирные связи образуются между рибонуклеотидами ферментом РНК-полимеразой . Цепь РНК синтезируется от 5'-конца к 3'-концу, поскольку 3'-гидроксильная группа последнего рибонуклеотида в цепи действует как нуклеофил и запускает гидрофильную атаку на 5'-трифосфат входящего рибонуклеотида, высвобождая пирофосфат в качестве побочного [6] продукта. Из-за физических свойств нуклеотидов остов РНК очень гидрофильный и полярный. При нейтральном pH нуклеиновые кислоты сильно заряжены, поскольку каждая фосфатная группа несет отрицательный заряд. [7]
И ДНК, и РНК построены из нуклеозидфосфатов, также известных как мононуклеотидные мономеры, которые термодинамически менее склонны к объединению, чем аминокислоты. Фосфодиэфирные связи при гидролизе высвобождают значительное количество свободной энергии. Поэтому нуклеиновые кислоты имеют тенденцию к спонтанному гидролизу в мононуклеотиды. Предшественниками РНК являются ГТФ, ЦТФ, УТФ и АТФ, который является основным источником энергии в реакциях переноса групп. [8]
Ученые полагают, что РНК возникла раньше ДНК. [9]
Восстановление рибонуклеотидов до дезоксирибонуклеотидов катализируется рибонуклеотидредуктазой . Рибонуклеотидредуктаза (РНР) является важным ферментом для всех живых организмов, поскольку она отвечает за последний этап синтеза четырех дезоксирибонуклеотидов (dNTP), необходимых для репликации и репарации ДНК. [10] Для реакции также требуются два других белка: тиоредоксин и тиоредоксинредуктаза . Рибонуклеозиддифосфат (НДФ) восстанавливается тиоредоксином до дезоксирибонуклеозиддифосфата (dNTP).
Общая реакция:
Рибонуклеозиддифосфат + НАДФН + H + → Дезоксирибонуклеозиддифосфат + НАДФ + + H 2 O [11]
Для иллюстрации этого уравнения, dATP и dGTP синтезируются из ADP и GDP соответственно. Сначала они восстанавливаются RNR, а затем фосфорилируются нуклеозиддифосфаткиназами до dATP и dGTP. Рибонуклеотидредуктаза контролируется аллостерическими взаимодействиями. Как только dATP связывается с рибонуклеотидредуктазой, общая каталитическая активность фермента снижается, так как это означает обилие дезоксирибонуклеотидов. Это ингибирование обратной связи обращается вспять, как только связывается АТФ. [12]
Во время синтеза ДНК ДНК-полимеразы должны выбирать против рибонуклеотидов, присутствующих на гораздо более высоких уровнях по сравнению с дезоксирибонуклеотидами. Крайне важно, чтобы была селективность, поскольку репликация ДНК должна быть точной для поддержания генома организма. Было показано, что активные сайты ДНК-полимераз семейства Y отвечают за поддержание высокой селективности против рибонуклеотидов. [13] Большинство ДНК-полимераз также оснащены возможностью исключения рибонуклеотидов из своего активного сайта через объемный остаток боковой цепи, который может стерически блокировать 2'-гидроксильную группу рибозного кольца. Однако многие ядерные репликативные и репаративные ДНК-полимеразы включают рибонуклеотиды в ДНК, [14] [15] что предполагает, что механизм исключения не идеален. [16]
Рибонуклеотиды могут синтезироваться в организмах из более мелких молекул через путь de novo или перерабатываться через путь спасения. В случае пути de novo как пурины, так и пиримидины синтезируются из компонентов, полученных из предшественников аминокислот, рибозо-5-фосфатов, CO 2 и NH 3 . [17] [12]

Биосинтез пуриновых нуклеотидов de novo довольно сложен и состоит из нескольких ферментативных реакций. Используя пятикольцевую сахарную структуру в качестве основы, пуриновое кольцо строится по несколько атомов за раз в одиннадцатишаговом процессе, который приводит к образованию инозината (ИМП). По сути, ИМП преобразуется в пуриновые нуклеотиды, необходимые для синтеза нуклеиновых кислот. [1]
Путь начинается с преобразования рибозо-5-фосфата (R5P) в фосфорибозилпирофосфат (PRPP) ферментом рибозофосфатдифосфокиназой (PRPS1). Затем PRPP преобразуется в 5-фосфорибозиламин (5-PRA), поскольку глутамин отдает аминогруппу C-1 PRPP. В реакции конденсации фермент GAR-синтетаза вместе с глицином и АТФ активирует группу глицинкарбоксилазы 5-PRA, образуя глицинамидрибонуклеотид (GAR). Затем кофермент N10-формил-ТГФ вместе с ферментом GAR-трансформилазой отдает одноуглеродную единицу аминогруппе на глицин GAR, после чего следует добавление глутамина ферментом FGAR-амидотрансферазой, что приводит к образованию формилглицинамидинрибонуклеотида (FGAM). Дегидратация FGAM ферментом FGAM циклазой приводит к замыканию имидазольного кольца в виде 5-аминоимидазолрибонуклеотида (AIR). Карбоксильная группа присоединяется к AIR синтетазой N5-CAIR с образованием рибонуклеотида N5-карбоксиаминоимидазола (N5-CAIR), который затем преобразуется в рибонуклеотид карбоксиаминоимидазола (CAIR) ферментом мутазой N5-CAIR. Фермент синтетаза SAICAR вместе с аминогруппой аспартата образует амидную связь с образованием рибонуклеотида N-сукцинил-5-аминоимидазол-4-карбоксамида (SAICAR). Продолжая путь, удаление углеродного скелета аспартата лиазой SAICAR приводит к образованию рибонуклеотида 5-аминоимидазол-4-карбоксамида (AICAR). Фермент AICAR трансформилаза помогает в окончательном переносе углерода из N10-формилтетрагидрофолата, образуя N-формиламиноимидазол-4-карбоксамид рибонуклеотид (FAICAR). Наконец, закрытие второй кольцевой структуры осуществляется IMP-синтазой с образованием IMP, где судьба IMP привела бы к образованию пуринового нуклеотида. [1]

Синтез пиримидиновых нуклеотидов — гораздо более простой процесс. Образование пиримидинового кольца начинается с преобразования аспартата в N-карбамоиласпартат путем проведения реакции конденсации с карбамоилфосфатом. Затем дигидрооротаза и дигидрооротазадегидрогеназа преобразуют N-карбамоиласпартат в оротат. Оротат ковалентно связывается с фосфорибозилпирофосфатом (PRPP) с помощью оротатфосфорибизолтрансферазы, образуя оротидинмонофосфат (OMP). OMP следует за декарбоксилированием с помощью оротидилатдекарбоксилазы с образованием структуры рибонуклеотида уридилата (UMP). Затем UMP может быть преобразован в уридин-5'-трифосфат (UTP) с помощью реакции двух киназ. Образование цитидин-5'-трифосфата (ЦТФ) из УТФ может быть достигнуто цитидилатсинтетазой с помощью промежуточного ацилфосфата. [1]
Чтобы понять, как возникла жизнь , необходимо знание химических путей, которые позволяют формировать ключевые строительные блоки жизни в вероятных пребиотических условиях . Согласно гипотезе мира РНК, в примитивном бульоне присутствовали свободно плавающие рибонуклеотиды. Это были фундаментальные молекулы, которые последовательно объединялись для образования РНК . Молекулы, столь сложные, как РНК, должны были возникнуть из небольших молекул, реакционная способность которых регулировалась физико-химическими процессами. РНК состоит из пуриновых и пиримидиновых нуклеотидов, оба из которых необходимы для надежной передачи информации и, таким образом, дарвиновского естественного отбора и эволюции . Синтез активированных пиримидиновых рибонуклеотидов был продемонстрирован в вероятных пребиотических условиях. [18] Исходные материалы для синтеза ( цианамид , цианоацетилен , гликольальдегид , глицеральдегид и неорганический фосфат ) считались вероятными молекулами пребиотического сырья. [18] Нам и др. продемонстрировали прямую конденсацию азотистых оснований с рибозой с образованием рибонуклеозидов в водных микрокаплях, что является ключевым шагом, ведущим к образованию РНК. [19] Кроме того, Беккер и др. представили вероятный пребиотический процесс синтеза пиримидиновых и пуриновых рибонуклеотидов с использованием циклов «влажный-сухой» [20].

До эпохальной статьи Джеймса Уотсона и Фрэнсиса Крика , в которой подробно описывалась структура ДНК на основе рентгеновской кристаллографии Розалинд Франклин , было несколько исторических ученых, которые также внесли свой вклад в ее открытие. [21] Фридрих Мишер , швейцарский врач, который в 1869 году первым выделил и идентифицировал нуклеиновое вещество из ядер белых кровяных клеток, которое он позже назвал «нуклеином», проложив путь к открытию ДНК. [22] Последователем работы Мишера был немецкий биохимик Альбрехт Коссель , который в 1878 году выделил небелковые компоненты «нуклеина» и открыл пять азотистых оснований, присутствующих в нуклеиновых кислотах: аденин, цитозин, гуанин, тимин и урацил. [23] Хотя благодаря этим ранним открытиям были известны некоторые фундаментальные факты о нуклеиновых кислотах, их структура и функции оставались загадкой.
Только после открытия нуклеотидов в 1919 году Фебусом Левеном , российско-литовским биохимиком, вновь открыли врата открытия ДНК. Левен первым определил, что углеводный компонент, присутствующий в дрожжевой РНК , на самом деле был рибозой . Однако только после его открытия того, что углеводный компонент в нуклеиновой кислоте тимуса также был сахаром, но не имел одного атома кислорода, названного дезоксирибозой , его открытие было широко оценено научным сообществом. В конце концов, Левен смог определить правильный порядок, в котором компоненты РНК и ДНК соединяются вместе, единицу фосфат-сахар-основание, в которой он позже назвал нуклеотидом . Хотя порядок компонентов нуклеотидов был хорошо понят Левеном, структура расположения нуклеотидов в пространстве и его генетический код все еще оставались загадкой в первые годы его карьеры. [24]