
Синтез ДНК — это естественное или искусственное создание молекул дезоксирибонуклеиновой кислоты (ДНК). ДНК — это макромолекула , состоящая из нуклеотидных единиц, связанных ковалентными и водородными связями в повторяющейся структуре. Синтез ДНК происходит, когда эти нуклеотидные единицы соединяются с образованием ДНК; это может происходить искусственно ( in vitro ) или естественным образом ( in vivo ). Нуклеотидные единицы состоят из азотистого основания (цитозина, гуанина, аденина или тимина), пентозного сахара (дезоксирибозы) и фосфатной группы. Каждая единица присоединяется, когда между ее фосфатной группой и пентозным сахаром следующего нуклеотида образуется ковалентная связь, образуя сахарофосфатный остов. ДНК представляет собой комплементарную двухцепочечную структуру, поскольку специфическое спаривание оснований (аденин и тимин, гуанин и цитозин) происходит естественным образом, когда между нуклеотидными основаниями образуются водородные связи.
Существует несколько различных определений синтеза ДНК: он может относиться к репликации ДНК — биосинтезу ДНК ( амплификация ДНК in vivo ), полимеразной цепной реакции — ферментативному синтезу ДНК ( амплификация ДНК in vitro ) или синтезу генов — физическому созданию искусственных последовательностей генов . Хотя каждый тип синтеза сильно отличается, у них есть некоторые общие черты. Нуклеотиды, которые соединились с образованием полинуклеотидов , могут действовать как матрица ДНК для одной из форм синтеза ДНК — ПЦР. Репликация ДНК также работает с использованием матрицы ДНК: двойная спираль ДНК раскручивается во время репликации, подвергая неспаренные основания новых нуклеотидов воздействию водородной связи. Однако синтез генов не требует матрицы ДНК, и гены собираются заново .
Синтез ДНК происходит у всех эукариот и прокариот , а также у некоторых вирусов . Точный синтез ДНК важен, чтобы избежать мутаций ДНК. У людей мутации могут привести к таким заболеваниям, как рак, поэтому синтез ДНК и механизмы, задействованные in vivo , широко изучались на протяжении десятилетий. В будущем эти исследования могут быть использованы для разработки технологий синтеза ДНК, которые будут использоваться для хранения данных.


В природе молекулы ДНК синтезируются всеми живыми клетками в процессе репликации ДНК . Обычно это происходит как часть клеточного деления . Репликация ДНК происходит таким образом, что во время деления клеток каждая дочерняя клетка содержит точную копию генетического материала клетки. Синтез ДНК in vivo ( репликация ДНК ) зависит от сложного набора ферментов , которые эволюционировали для согласованного действия во время S-фазы клеточного цикла. И у эукариот , и у прокариот репликация ДНК происходит, когда специфические топоизомеразы , геликазы и гиразы (белки-инициаторы репликации) раскручивают двухцепочечную ДНК, обнажая азотистые основания. [1] Эти ферменты вместе с вспомогательными белками образуют макромолекулярную машину, которая обеспечивает точное дублирование последовательностей ДНК. Происходит комплементарное спаривание оснований, образующее новую двухцепочечную молекулу ДНК. Это известно как полуконсервативная репликация, поскольку одна цепь новой молекулы ДНК происходит от «родительской» цепи.
Постоянно эукариотические ферменты сталкиваются с повреждениями ДНК, которые могут нарушить репликацию ДНК. Это повреждение проявляется в форме повреждений ДНК, которые возникают спонтанно или из-за агентов, повреждающих ДНК. Поэтому механизм репликации ДНК строго контролируется, чтобы предотвратить разрушение при возникновении повреждений. [2] Контроль системы репликации ДНК гарантирует, что геном реплицируется только один раз за цикл; чрезмерная репликация вызывает повреждение ДНК. Дерегуляция репликации ДНК является ключевым фактором геномной нестабильности во время развития рака. [3]
Это подчеркивает специфичность механизма синтеза ДНК in vivo . Существуют различные способы искусственной стимуляции репликации естественной ДНК или создания искусственных последовательностей генов. Однако синтез ДНК in vitro может оказаться очень подверженным ошибкам процессом.
Поврежденная ДНК подлежит восстановлению с помощью нескольких различных ферментативных процессов восстановления , где каждый отдельный процесс специализируется на восстановлении определенных типов повреждений. ДНК человека подвержена повреждениям из-за множества природных источников, а недостаточное восстановление связано с болезнями и преждевременным старением . [4] Большинство процессов репарации ДНК образуют одноцепочечные разрывы в ДНК на промежуточной стадии репарации, и эти пробелы заполняются путем репарационного синтеза. [4] Конкретные процессы репарации, которые требуют заполнения пробелов путем синтеза ДНК, включают эксцизионную репарацию нуклеотидов , эксцизионную репарацию оснований , репарацию несоответствия , гомологичную рекомбинационную репарацию, негомологическое соединение концов и микрогомологическое соединение концов .
Обратная транскрипция является частью цикла репликации определенных семейств вирусов, включая ретровирусы . Он включает копирование РНК в двухцепочечную комплементарную ДНК (кДНК) с использованием ферментов обратной транскриптазы . У ретровирусов вирусная РНК встраивается в ядро клетки-хозяина. Там фермент вирусной обратной транскриптазы добавляет нуклеотиды ДНК к последовательности РНК, генерируя кДНК, которая встраивается в геном клетки-хозяина с помощью фермента интегразы , кодирующего вирусные белки. [5]
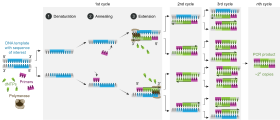
Полимеразная цепная реакция — это форма ферментативного синтеза ДНК в лаборатории, в которой используются циклы повторяющегося нагревания и охлаждения реакции плавления ДНК и ферментативной репликации ДНК.
Синтез ДНК во время ПЦР очень похож на синтез живых клеток, но требует очень специфических реагентов и условий. Во время ПЦР ДНК химически экстрагируется из белков-шаперонов хозяина, а затем нагревается, вызывая термическую диссоциацию нитей ДНК. Две новые цепи кДНК строятся из исходной цепи, эти цепи можно снова разделить, чтобы использовать в качестве матрицы для дальнейших продуктов ПЦР. Исходная ДНК размножается посредством многих раундов ПЦР. [1] Можно создать более миллиарда копий исходной цепи ДНК.
Для многих экспериментов, таких как структурные и эволюционные исследования, ученым необходимо создать большую библиотеку вариантов определенной последовательности ДНК. Случайный мутагенез происходит in vitro, когда мутагенная репликация с использованием ДНК-полимеразы низкой точности сочетается с селективной ПЦР-амплификацией для получения множества копий мутантной ДНК. [6]
ОТ-ПЦР отличается от обычной ПЦР, поскольку она синтезирует кДНК из мРНК, а не из матричной ДНК. Этот метод сочетает реакцию обратной транскрипции с амплификацией на основе ПЦР, поскольку последовательность РНК действует как матрица для фермента обратной транскриптазы. RT-PCR часто используется для проверки экспрессии генов в определенных типах тканей или клеток на различных стадиях развития или для проверки генетических нарушений. [7]
Синтез искусственных генов — это процесс синтеза гена in vitro без необходимости использования исходных образцов матричной ДНК. В 2010 году Дж. Крейг Вентер и его команда первыми использовали полностью синтезированную ДНК для создания самовоспроизводящегося микроба, получившего название Mycoplasma Laboratorium . [8]
Синтез олигонуклеотидов — это химический синтез последовательностей нуклеиновых кислот. Большинство биологических исследований и биоинженерии используют синтетическую ДНК, которая может включать олигонуклеотиды , синтетические гены или даже хромосомы . Сегодня вся синтетическая ДНК создается по индивидуальному заказу с использованием фосфорамидитного метода Марвина Х. Карутерса . Олигосинтезируются из строительных блоков, повторяющих природные основания. Этот процесс был автоматизирован с конца 1970-х годов и может использоваться для формирования желаемых генетических последовательностей, а также для других целей в медицине и молекулярной биологии. Однако создание химических последовательностей непрактично за пределами 200-300 оснований и является экологически опасным процессом. Эти олигонуклеотиды, состоящие примерно из 200 оснований, можно соединить с помощью методов сборки ДНК, создавая более крупные молекулы ДНК. [9]
В некоторых исследованиях изучалась возможность ферментативного синтеза с использованием терминальной дезоксинуклеотидилтрансферазы (TdT), ДНК-полимеразы, не требующей матрицы. Однако этот метод пока не так эффективен, как химический синтез, и коммерчески недоступен. [10]
С развитием искусственного синтеза ДНК изучается возможность хранения данных ДНК . Благодаря сверхвысокой плотности хранения и долгосрочной стабильности синтетическая ДНК является интересным вариантом для хранения больших объемов данных. Хотя информацию можно получить из ДНК очень быстро с помощью технологий секвенирования следующего поколения, синтез ДНК de novo является основным узким местом в этом процессе. За цикл можно добавить только один нуклеотид, причем каждый цикл занимает несколько секунд, поэтому общий синтез занимает очень много времени, а также очень подвержен ошибкам. Однако, если биотехнология улучшится, синтетическую ДНК однажды можно будет использовать для хранения данных. [11]
Сообщалось, что могут быть синтезированы новые пары нуклеиновых оснований , а также АТ ( аденин - тимин ) и GC ( гуанин - цитозин ). Синтетические нуклеотиды можно использовать для расширения генетического алфавита и обеспечения специфической модификации участков ДНК. Даже всего лишь третья пара оснований увеличит количество аминокислот, которые могут быть закодированы ДНК, с существующих 20 аминокислот до возможных 172. [8] ДНК хатимодзи построена из восьми букв-нуклеотидов, образующих четыре возможные пары оснований. Таким образом, это удваивает информационную плотность природной ДНК. В исследованиях РНК даже была получена из ДНК хатимодзи. Эту технологию также можно использовать для хранения данных в ДНК. [12]