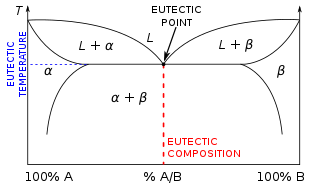
Эвтектическая система или эвтектическая смесь ( / j uː ˈ t ɛ k t ɪ k / yoo- TEK -tik ) [1] представляет собой тип однородной смеси , температура плавления которой ниже, чем у ее компонентов. [2] Самая низкая возможная температура плавления при всех соотношениях смешивания компонентов называется эвтектической температурой . На фазовой диаграмме эвтектическая температура отображается как эвтектическая точка (см. график справа). [3]
Неэвтектические смеси имеют разные температуры плавления для разных компонентов, так как решетка одного компонента будет плавиться при более низкой температуре, чем другого. И наоборот, по мере охлаждения неэвтектической смеси каждый из ее компонентов затвердевает в решетку при другой температуре, пока вся масса не станет твердой. Таким образом, неэвтектическая смесь не имеет единой температуры плавления/замерзания, при которой она меняет фазу, а скорее температуру, при которой она переходит из жидкого состояния в кашицу (известную как ликвидус ) , и более низкую температуру, при которой она переходит из кашицы в твердое состояние ( солидус ).
В реальном мире эвтектические свойства могут быть использованы с пользой в таких процессах, как эвтектическое соединение , когда кремниевые чипы прикрепляются к позолоченным подложкам с помощью ультразвука , а эвтектические сплавы оказываются ценными в таких разнообразных областях применения, как пайка мягким и твердым припоем, литье металлов, электрозащита, системы пожаротушения и нетоксичные заменители ртути.
Термин «эвтектика» был придуман в 1884 году британским физиком и химиком Фредериком Гатри (1833–1886). Слово происходит от греческого εὐ - (eû) «хорошо» и τῆξῐς (têxis) «плавление». [2] До его исследований химики предполагали, «что сплав с минимальной температурой плавления должен иметь свои компоненты в некоторых простых атомных пропорциях», что действительно было доказано. [4]

Эвтектическое затвердевание определяется следующим образом: [5]
Этот тип реакции является инвариантной реакцией, поскольку находится в тепловом равновесии ; другой способ определить это - изменение свободной энергии Гиббса равно нулю. Ощутимо это означает, что жидкость и два твердых раствора сосуществуют одновременно и находятся в химическом равновесии . Существует также тепловая остановка на время фазового перехода , в течение которого температура системы не меняется. [5]
Получающаяся в результате эвтектической реакции твердая макроструктура зависит от нескольких факторов, наиболее важным из которых является то, как зарождаются и растут два твердых раствора. Наиболее распространенной структурой является пластинчатая структура , но другие возможные структуры включают стержнеобразную, глобулярную и игольчатую . [6]
Составы эвтектических систем, не находящиеся в эвтектической точке, можно классифицировать как доэвтектические или гиперэвтектические :
При понижении температуры неэвтектического состава жидкая смесь будет осаждаться одним компонентом смеси раньше другого. В гиперэвтектическом растворе будет присутствовать проэвтектоидная фаза вида β, тогда как в доэвтектическом растворе будет присутствовать проэвтектическая α-фаза. [5]
Эвтектические сплавы состоят из двух или более материалов и имеют эвтектический состав. Когда затвердевает неэвтектический сплав, его компоненты затвердевают при разных температурах, демонстрируя пластичный диапазон плавления. Наоборот, когда плавится хорошо перемешанный эвтектический сплав, он делает это при одной, резкой температуре. Различные фазовые превращения, происходящие во время затвердевания определенного состава сплава, можно понять, проведя вертикальную линию от жидкой фазы к твердой фазе на фазовой диаграмме для этого сплава.
Некоторые области применения эвтектических сплавов включают:

Первичным механизмом упрочнения эвтектической структуры в металлах является композитное упрочнение (см. механизмы упрочнения материалов ). Этот механизм деформации работает посредством передачи нагрузки между двумя составными фазами, где более податливая фаза передает напряжение более жесткой фазе. [15] Используя преимущество прочности жесткой фазы и пластичности податливой фазы, общая прочность материала увеличивается. По мере того, как состав изменяется либо до доэвтектических, либо до гиперэвтектических образований, механизм передачи нагрузки становится более сложным, поскольку происходит передача нагрузки между эвтектической фазой и вторичной фазой, а также передача нагрузки внутри самой эвтектической фазы.
Вторым регулируемым механизмом усиления эвтектических структур является расстояние между вторичной фазой. При изменении расстояния между вторичной фазой также изменяется доля контакта между двумя фазами через общие границы фаз. При уменьшении расстояния между эвтектической фазой, создавая тонкую эвтектическую структуру, большая площадь поверхности распределяется между двумя составляющими фазами, что приводит к более эффективному переносу нагрузки. [16] На микроуровне дополнительная площадь границы действует как барьер для дислокаций, еще больше укрепляя материал. В результате этого механизма усиления грубые эвтектические структуры имеют тенденцию быть менее жесткими, но более пластичными, в то время как тонкие эвтектические структуры являются более жесткими, но более хрупкими. [16] Расстояние между эвтектической фазой можно контролировать во время обработки, поскольку оно напрямую связано со скоростью охлаждения во время затвердевания эвтектической структуры. Например, для простой пластинчатой эвтектической структуры минимальное расстояние между пластинами составляет: [17]
Где is — поверхностная энергия двухфазной границы, — молярный объем эвтектической фазы, — температура затвердевания эвтектической фазы, — энтальпия образования эвтектической фазы, — переохлаждение материала. Таким образом, изменяя переохлаждение и, соответственно, скорость охлаждения, можно контролировать минимально достижимое расстояние между вторичными фазами.
Укрепление металлических эвтектических фаз для сопротивления деформации при высоких температурах (см. деформация ползучести ) более запутано, поскольку первичный механизм деформации изменяется в зависимости от уровня приложенного напряжения. При высоких температурах, когда деформация доминирует за счет движения дислокаций, упрочнение от передачи нагрузки и вторичного фазового интервала сохраняется, поскольку они продолжают сопротивляться движению дислокаций. При более низких деформациях, когда преобладает ползучесть Набарро-Херринга, форма и размер структуры эвтектической фазы играют значительную роль в деформации материала, поскольку они влияют на доступную граничную область для диффузии вакансий. [18]

Когда раствор выше точки превращения твердый, а не жидкий, может произойти аналогичное эвтектоидное превращение. Например, в системе железо-углерод аустенитная фаза может претерпеть эвтектоидное превращение с образованием феррита и цементита , часто в пластинчатых структурах, таких как перлит и бейнит . Эта эвтектоидная точка возникает при 723 °C (1333 °F) и 0,76 мас.% углерода. [19]
Перитектоидное превращение — это тип изотермической обратимой реакции , в которой две твердые фазы реагируют друг с другом при охлаждении бинарного, тройного, ..., n -арного сплава, создавая совершенно другую и единую твердую фазу. [20] Реакция играет ключевую роль в упорядочении и разложении квазикристаллических фаз в нескольких типах сплавов. [21] Похожий структурный переход также прогнозируется для вращающихся столбчатых кристаллов .

Перитектические превращения также похожи на эвтектические реакции. Здесь жидкая и твердая фазы фиксированных пропорций реагируют при фиксированной температуре, давая одну твердую фазу. Поскольку твердый продукт образуется на границе раздела между двумя реагентами, он может образовывать диффузионный барьер и, как правило, заставляет такие реакции протекать гораздо медленнее, чем эвтектические или эвтектоидные превращения. Из-за этого, когда перитектический состав затвердевает, он не показывает пластинчатую структуру , которая обнаруживается при эвтектическом затвердевании.
Такое превращение существует в системе железо-углерод, как видно около верхнего левого угла рисунка. Оно напоминает перевернутую эвтектику, в которой δ-фаза соединяется с жидкостью, образуя чистый аустенит при 1495 °C (2723 °F) и 0,17% углерода.
При температуре перитектического разложения соединение, вместо того чтобы плавиться, распадается на другое твердое соединение и жидкость. Пропорция каждого определяется правилом рычага . Например, на фазовой диаграмме Al-Au можно увидеть, что только две фазы плавятся конгруэнтно, AuAl 2 и Au 2 Al , в то время как остальные перитектически разлагаются.
Не все системы с минимальной температурой плавления являются «эвтектическими». Альтернативу «плохого твердого раствора» можно проиллюстрировать, сравнив распространенные системы драгоценных металлов Cu-Ag и Cu-Au. Cu-Ag, источник, например https://himikatus.ru/art/phase-diagr1/Ag-Cu.php, является истинной эвтектической системой. Температура плавления эвтектики составляет 780 °C, с пределами растворимости в твердом состоянии при пробе 80 и 912 по весу, и эвтектикой при 719. Поскольку Cu-Ag является истинной эвтектикой, любое серебро с пробой в любом месте между 80 и 912 достигнет линии солидуса и, следовательно, расплавится, по крайней мере, частично, точно при 780 °C. Эвтектический сплав с пробой точно 719 достигнет линии ликвидуса и, следовательно, расплавится полностью, при этой точной температуре без дальнейшего повышения температуры, пока весь сплав не расплавится. Любое серебро с пробой от 80 до 912, но не точно 719, также достигнет линии солидуса точно при 780 °C, но расплавится частично. Оно оставит твердый остаток с пробой либо точно 912, либо точно 80, но никогда не часть того и другого. Оно будет плавиться при постоянной температуре без дальнейшего повышения температуры до тех пор, пока точное количество эвтектического (проба 719) сплава не расплавится, чтобы разделить сплав на эвтектический расплав и остаток твердого раствора. При дальнейшем нагревании остаток твердого раствора растворяется в расплаве и меняет свой состав до тех пор, пока не будет достигнута линия ликвидуса, и весь остаток не растворится. Источник Cu-Au, например, https://himikatus.ru/art/phase-diagr1/Au-Cu.php действительно показывает минимум температуры плавления при 910 °C и указан как 44 атомных % Cu, что преобразуется примерно в 20 весовых процентов Cu - около 800 пробы золота. Но это не настоящая эвтектика. 800 чистого золота плавится при 910 °C, образуя расплав точно такого же состава, и весь сплав будет плавиться при точно такой же температуре. Но различия происходят вдали от минимального состава. В отличие от серебра с чистотой, отличной от 719 (которое плавится частично при температуре точно 780 °C в широком диапазоне чистоты), золото с чистотой, отличной от 800, достигнет солидуса и начнет частичное плавление при температуре, отличной от 910 °C и выше, в зависимости от чистоты сплава. Частичное плавление действительно вызывает некоторые изменения состава - жидкость будет ближе по чистоте к 800, чем оставшееся твердое вещество, но жидкость не будет иметь чистоту точно 800, а чистота оставшегося твердого вещества будет зависеть от тонкости жидкости. Основная причина заключается в том, что для эвтектической системы, такой как Cu-Ag, растворимость в жидкой фазе хорошая, но растворимость в твердой фазе ограничена. Поэтому при замораживании сплава серебра и меди он фактически разделяется на кристаллы серебра 912 пробы и серебра 80 пробы — оба являются насыщенными и всегда имеют одинаковый состав при температуре замерзания 780 °C. Таким образом, сплав при температуре чуть ниже 780 °C состоит из двух типов кристаллов абсолютно одинакового состава независимо от общего состава сплава, отличается только относительное количество кристаллов каждого типа.Поэтому они всегда плавятся при 780 C до тех пор, пока один или другой тип кристаллов, или оба, не будут исчерпаны. Напротив, в системе Cu-Au компоненты смешиваются при температуре плавления во всех составах, даже в твердом состоянии. Могут быть кристаллы любого состава, которые будут плавиться при разных температурах в зависимости от состава. Однако система Cu-Au является «плохим» твердым раствором. Существует существенное несоответствие между атомами в твердом состоянии, которое, однако, вблизи точки плавления преодолевается энтропией теплового движения, смешивающего атомы. Это несоответствие, однако, неблагоприятно для раствора Cu-Au по сравнению с фазами, в которых атомы лучше подогнаны, такими как расплав, и приводит к тому, что температура плавления падает ниже температуры плавления компонентов.
Состав и температуру эвтектики можно рассчитать из энтальпии и энтропии плавления каждого компонента. [22]
Свободная энергия Гиббса G зависит от ее собственного дифференциала:
Таким образом, производная G / T при постоянном давлении рассчитывается по следующему уравнению:
Химический потенциал рассчитывается, если предположить, что активность равна концентрации:
В равновесии , таким образом, получается как
Используя [ необходимо разъяснение ] и интегрируя, получаем
Константу интегрирования К можно определить для чистого компонента с температурой плавления и энтальпией плавления :
Получаем соотношение, определяющее молярную долю в зависимости от температуры для каждого компонента:
Смесь из n компонентов описывается системой
которые можно решить
Главный аргумент настоящего сообщения основан на существовании составных тел, главной характеристикой которых является низкая температура плавления. Это свойство тел можно назвать Eutexia, а тела, обладающие им, — эвтектическими телами или эвтектиками (
εὖ τήκειν
).