Распространенность химических элементов является мерой встречаемости химических элементов относительно всех других элементов в данной среде. Распространенность измеряется одним из трех способов: массовой долей (в коммерческом контексте часто называемой весовой долей ), молярной долей (долей атомов по численному счету или иногда долей молекул в газах) или объемной долей . Объемная доля является распространенной мерой распространенности в смешанных газах, таких как планетарные атмосферы, и по значению близка к молекулярной молярной доле для газовых смесей при относительно низких плотностях и давлениях и идеальных газовых смесях. Большинство значений распространенности в этой статье приведены в виде массовых долей.
Распространенность химических элементов во Вселенной определяется большим количеством водорода и гелия, которые были произведены во время нуклеосинтеза Большого Взрыва . Остальные элементы, составляющие всего около 2% Вселенной, были в основном произведены нуклеосинтезом сверхновых . Элементы с четными атомными номерами , как правило, более распространены, чем их соседи в периодической таблице , из-за их благоприятной энергетики образования, описываемой правилом Оддо-Харкинса .
Распространенность элементов на Солнце и внешних планетах аналогична распространенности во Вселенной. Из-за солнечного нагрева элементы Земли и внутренних каменистых планет Солнечной системы подверглись дополнительному истощению летучих водорода, гелия, неона, азота и углерода (который улетучивается как метан ). Кора, мантия и ядро Земли демонстрируют признаки химической сегрегации и некоторой секвестрации по плотности. Более легкие силикаты алюминия обнаружены в коре, с большим количеством силиката магния в мантии, в то время как металлическое железо и никель составляют ядро. Распространенность элементов в специализированных средах, таких как атмосфера, океаны или человеческое тело, в первую очередь является продуктом химического взаимодействия со средой, в которой они находятся.
Распространенность каждого элемента выражается как относительное число. Астрономия использует логарифмическую шкалу распространенности для распространенности элемента X относительно водорода, определяемую для плотности числа ; на этой шкале. [1] Другая шкала — массовая доля или, что эквивалентно, процент по массе. [2]
Например, содержание кислорода в чистой воде можно измерить двумя способами: массовая доля составляет около 89%, поскольку это доля массы воды, которая является кислородом. Однако мольная доля составляет около 33%, поскольку только 1 атом из 3 в воде, H 2 O, является кислородом. В качестве другого примера, если посмотреть на массовую долю содержания водорода и гелия как во Вселенной в целом, так и в атмосферах газовых гигантских планет, таких как Юпитер , то она составляет 74% для водорода и 23–25% для гелия ; в то время как (атомная) мольная доля для водорода составляет 92%, а для гелия — 8% в этих средах. Изменение заданной среды на внешнюю атмосферу Юпитера , где водород является двухатомным , а гелий — нет, изменяет молекулярную мольную долю (долю от общего количества молекул газа), а также долю атмосферы по объему, водорода примерно до 86%, а гелия — до 13%. Под внешней атмосферой Юпитера объемные доли существенно отличаются от мольных долей из-за высоких температур ( ионизация и диспропорционирование ) и высокой плотности, где закон идеального газа неприменим.
Обилие химических элементов во Вселенной определяется большим количеством водорода и гелия, которые были произведены во время нуклеосинтеза Большого Взрыва . Остальные элементы, составляющие всего около 2% Вселенной, были в основном произведены сверхновыми и некоторыми красными гигантскими звездами . Литий , бериллий и бор , несмотря на их низкий атомный номер, редки, потому что, хотя они производятся в результате ядерного синтеза, они разрушаются другими реакциями в звездах. [4] [5] Их естественное возникновение является результатом расщепления углерода, азота и кислорода космическими лучами в типе реакции ядерного деления. Элементы от углерода до железа относительно более распространены во Вселенной из-за легкости их получения в нуклеосинтезе сверхновых . Элементы с более высокими атомными номерами, чем железо (элемент 26), становятся все более редкими во Вселенной, потому что они все больше поглощают звездную энергию при своем производстве. Кроме того, элементы с четными атомными номерами , как правило, встречаются чаще, чем их соседи в периодической таблице , из-за благоприятной энергетики образования (см. правило Оддо-Харкинса ), а среди самых легких нуклидов от гелия до серы наиболее распространены изотопы с равным числом протонов и нейтронов.
Водород является самым распространенным элементом во Вселенной; гелий занимает второе место. Все остальные на порядки менее распространены. После этого ранг распространенности не продолжает соответствовать атомному номеру . Кислород имеет ранг распространенности 3, но атомный номер 8.

Существует 80 известных стабильных элементов , и самые легкие 16 из них составляют 99,9% обычной материи Вселенной. Эти же 16 элементов, от водорода до серы, попадают в начальную линейную часть таблицы нуклидов (также называемую графиком Сегре ), графиком числа протонов и нейтронов всей материи, как обычной, так и экзотической, содержащей сотни стабильных изотопов и тысячи других, которые являются нестабильными. График Сегре изначально линеен, потому что (кроме водорода) подавляющее большинство обычной материи (99,4% в Солнечной системе [6] ) содержит равное количество протонов и нейтронов (Z=N). Конечно, 74% обычной материи существует в виде мононуклонных протонов (водорода). Но когда нуклоны объединяются, образуя стабильные нуклиды, они объединяются в соотношении одна часть протона к одной части нейтрона в 99,4% обычной материи. Структурная основа равенства чисел нуклонов в барионной материи — одна из самых простых и глубоких неразгаданных тайн атомного ядра.
Распространенность самых легких элементов хорошо предсказывается стандартной космологической моделью , поскольку они в основном были произведены вскоре (т. е. в течение нескольких сотен секунд) после Большого взрыва, в процессе, известном как нуклеосинтез Большого взрыва . Более тяжелые элементы в основном были произведены гораздо позже, в звездном нуклеосинтезе .
Водород и гелий, по оценкам, составляют примерно 74% и 24% всей барионной материи во Вселенной соответственно. Несмотря на то, что они составляют лишь очень малую часть Вселенной, оставшиеся «тяжелые элементы» могут значительно влиять на астрономические явления. Только около 2% (по массе) диска галактики Млечный Путь состоит из тяжелых элементов.
Эти другие элементы генерируются звездными процессами. [7] [8] [9] В астрономии « металл » — это любой элемент, кроме водорода или гелия. Это различие имеет важное значение, поскольку водород и гелий — единственные элементы, которые были произведены в значительных количествах во время Большого взрыва. Таким образом, металличность галактики или другого объекта является показателем звездной активности после Большого взрыва.
В целом, элементы вплоть до железа производятся крупными звездами в процессе превращения в сверхновые или более мелкими звездами в процессе умирания. Железо-56 особенно распространено, поскольку это самый стабильный нуклид (в том смысле, что он имеет самую высокую ядерную энергию связи на нуклон) и может легко «построиться» из альфа-частиц (будучи продуктом распада радиоактивного никеля-56 , в конечном итоге состоящего из 14 ядер гелия). Элементы тяжелее железа производятся в энергопоглощающих процессах в крупных звездах, и их распространенность во Вселенной (и на Земле) обычно уменьшается с увеличением атомного номера.
Таблица показывает десять наиболее распространенных элементов в нашей галактике (оцененных спектроскопически ), измеренных в частях на миллион, по массе. [3] Близлежащие галактики, которые эволюционировали по схожим линиям, имеют соответствующее обогащение элементами тяжелее водорода и гелия. Более далекие галактики рассматриваются такими, какими они были в прошлом , поэтому их обилие элементов кажется ближе к изначальной смеси. Однако, поскольку физические законы и процессы, по-видимому, единообразны во всей Вселенной, ожидается, что эти галактики также эволюционировали с похожим обилием элементов.
Как показано в периодической таблице , распространенность элементов соответствует их происхождению. Очень распространенные водород и гелий являются продуктами Большого взрыва. Следующие три элемента в периодической таблице ( литий , бериллий и бор ) редки, несмотря на их низкий атомный номер. У них было мало времени для образования во время Большого взрыва. Они производятся в небольших количествах в результате ядерного синтеза в умирающих звездах или при распаде более тяжелых элементов в межзвездной пыли, вызванном расщеплением космических лучей . В сверхновых звездах они производятся в результате ядерного синтеза, но затем разрушаются другими реакциями. [4]
Более тяжелые элементы, начиная с углерода , были получены в умирающих или сверхновых звездах путем накопления альфа-частиц (ядер гелия), способствуя попеременно большему распространению элементов с четными атомными числами (они также более стабильны). Эффект того, что химические элементы с нечетными числами, как правило, более редки во Вселенной, был эмпирически замечен в 1914 году и известен как правило Оддо-Харкинса .
Следующий график ( в логарифмическом масштабе ) показывает распространенность элементов в Солнечной системе .

Наблюдались слабые корреляции между предполагаемым содержанием элементов во Вселенной и кривой энергии связи ядра (также называемой энергией связи на нуклон ). Грубо говоря, относительная стабильность различных атомных нуклидов в выдерживании чрезвычайно энергетических условий нуклеосинтеза Большого взрыва (BBN) оказала сильное влияние на относительное содержание элементов, образовавшихся во время Большого взрыва, и в ходе развития Вселенной после этого. [10] См. статью о нуклеосинтезе для объяснения того, как определенные процессы ядерного синтеза в звездах (такие как горение углерода и т. д.) создают элементы тяжелее водорода и гелия.
Еще одной наблюдаемой особенностью является неровное чередование между относительной распространенностью и редкостью соседних атомных чисел в оцененных распространенностях химических элементов, в которых относительное распространенность четных атомных чисел примерно на 2 порядка больше относительного распространенности нечетных атомных чисел ( правило Оддо-Харкинса ). Аналогичное чередование между четными и нечетными атомными числами можно наблюдать на кривой энергии ядерной связи в окрестности углерода и кислорода, но здесь слабая корреляция между относительной распространенностью и энергией связи заканчивается. Энергия связи для бериллия (четное атомное число), например, меньше энергии связи для бора (нечетное атомное число), как показано на кривой энергии ядерной связи. Кроме того, чередование в энергии ядерной связи между четными и нечетными атомными числами разрешается выше кислорода, поскольку график неуклонно возрастает до своего пика у железа. Полуэмпирическая массовая формула (SEMF), также называемая формулой Вайцзеккера или массовой формулой Бете-Вайцзеккера , дает теоретическое объяснение общей формы кривой энергии ядерной связи. [11]
Современная астрономия опирается на понимание распространенности элементов на Солнце как части космологических моделей. Значения распространенности трудно получить: даже фотосферные или наблюдаемые распространенности зависят от моделей солнечной атмосферы и радиационной связи. [1] Эти астрономические значения распространенности сообщаются как логарифмы отношения с водородом. Водород установлен на распространенность 12 по этой шкале.
Фотосфера Солнца состоит в основном из водорода и гелия; содержание гелия колеблется от 10,3 до 10,5 в зависимости от фазы солнечного цикла ; [12] содержание углерода составляет 8,47, неона — 8,29, кислорода — 7,69 [13] и железа оценивается в 7,62. [14]

Земля образовалась из того же облака материи , что и Солнце, но планеты приобрели разный состав в ходе формирования и эволюции Солнечной системы . В свою очередь, история Земли привела к тому, что части планеты имели разную концентрацию элементов.
Масса Земли составляет приблизительно 5,97 × 1024 кг. По массе он состоит в основном из железа (32,1%), кислорода (30,1%), кремния (15,1%), магния (13,9%), серы (2,9%), никеля (1,8%), кальция (1,5%) и алюминия (1,4%); оставшиеся 1,2% состоят из следовых количеств других элементов. [15]
Общий состав Земли по элементарной массе примерно аналогичен общему составу Солнечной системы, при этом основные различия заключаются в том, что на Земле отсутствует значительная часть летучих элементов: водорода, гелия, неона и азота, а также углерода, который был утрачен в виде летучих углеводородов .
Оставшийся элементный состав примерно типичен для «каменистых» внутренних планет , которые сформировались «внутри» « линии замерзания » вблизи Солнца, где тепло молодого Солнца и звездный ветер выносили летучие соединения в космос.
Кислород остается вторым по величине компонентом массы Земли (и крупнейшей атомной долей), что обусловлено в основном его высокой реакционной способностью; это привело к его связыванию в силикатные минералы , имеющие высокую температуру плавления и низкое давление паров.
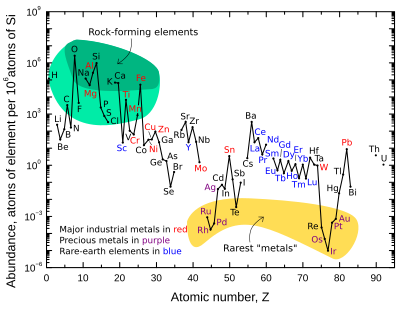
Массовая распространенность девяти наиболее распространенных элементов в земной коре составляет примерно: кислород 46%, кремний 28%, алюминий 8,3%, железо 5,6%, кальций 4,2%, натрий 2,5%, магний 2,4%, калий 2,0% и титан 0,61%. Другие элементы встречаются в количествах менее 0,15%. Полный список см. в разделе распространенность элементов в земной коре .
График справа иллюстрирует относительное содержание атомов химических элементов в верхней континентальной коре Земли — той ее части, которая относительно доступна для измерений и оценки.
Многие элементы, показанные на графике, классифицированы по (частично перекрывающимся) категориям:
Есть два разрыва, где должны были бы быть нестабильные элементы технеций (атомный номер 43) и прометий (номер 61). Эти элементы окружены стабильными элементами, однако их наиболее стабильные изотопы имеют относительно короткие периоды полураспада (~4 миллиона лет и ~18 лет соответственно). Таким образом, они чрезвычайно редки, поскольку любые первичные количества этих элементов давно распались. Эти два элемента в настоящее время производятся естественным путем только путем спонтанного деления очень тяжелых радиоактивных элементов (таких как уран , торий или следовые количества плутония , которые существуют в урановых рудах) или путем взаимодействия некоторых других элементов с космическими лучами . И технеций, и прометий были идентифицированы спектроскопически в атмосферах звезд, где они производятся в ходе текущих нуклеосинтетических процессов.
Также имеются разрывы в графике распространенности там, где должны быть шесть благородных газов , поскольку они химически не связаны в земной коре, и поэтому их распространенность в земной коре не определена четко.
Восемь встречающихся в природе очень редких, высокорадиоактивных элементов ( полоний , астат , франций , радий , актиний , протактиний , нептуний и плутоний ) не включены, поскольку все эти элементы, присутствовавшие при формировании Земли, распались много веков назад, и их количество сегодня ничтожно мало, и они производятся только в результате радиоактивного распада урана и тория.
Кислород и кремний являются наиболее распространенными элементами в коре. На Земле и каменистых планетах в целом кремний и кислород встречаются гораздо чаще, чем их космическое изобилие. Причина в том, что они соединяются друг с другом, образуя силикатные минералы . [17] Другие космически распространенные элементы, такие как водород , углерод и азот, образуют летучие соединения, такие как аммиак и метан , которые легко испаряются в космосе от тепла планетарного формирования и/или солнечного света.
«Редкие» элементы земли — историческое неправильное название. Устойчивость этого термина отражает незнакомость, а не истинную редкость. Более распространенные редкоземельные элементы концентрируются в земной коре аналогично обычным промышленным металлам, таким как хром, никель, медь, цинк, молибден, олово, вольфрам или свинец. Два наименее распространенных стабильных редкоземельных элемента ( тулий и лютеций ) встречаются почти в 200 раз чаще золота . Однако, в отличие от обычных цветных и драгоценных металлов, редкоземельные элементы имеют очень небольшую тенденцию концентрироваться в пригодных для разработки рудных месторождениях. Следовательно, большая часть мировых запасов редкоземельных элементов поступает всего из нескольких источников. Кроме того, все редкоземельные металлы химически довольно похожи друг на друга, и поэтому их довольно трудно разделить на количества чистых элементов.
Различия в распространенности отдельных редкоземельных элементов в верхней континентальной коре Земли представляют собой суперпозицию двух эффектов, одного ядерного и одного геохимического. Во-первых, редкоземельные элементы с четными атомными номерами ( 58 Ce, 60 Nd, ...) имеют большую космическую и земную распространенность, чем соседние редкоземельные элементы с нечетными атомными номерами ( 57 La, 59 Pr, ...). Во-вторых, более легкие редкоземельные элементы более несовместимы (потому что имеют большие ионные радиусы) и, следовательно, сильнее концентрируются в континентальной коре, чем более тяжелые редкоземельные элементы. В большинстве месторождений редкоземельных руд первые четыре редкоземельных элемента — лантан , церий , празеодим и неодим — составляют от 80% до 99% от общего количества редкоземельного металла, которое может быть найдено в руде.
Массовая доля семи наиболее распространенных элементов в мантии Земли составляет приблизительно: кислород 44,3%, магний 22,3%, кремний 21,3%, железо 6,32%, кальций 2,48%, алюминий 2,29%, никель 0,19%. [18]
Из-за массовой сегрегации считается, что ядро Земли в основном состоит из железа (88,8%), с меньшим количеством никеля (5,8%), серы (4,5%) и менее чем 1% микроэлементов. [6]
Наиболее распространенными элементами в океане по массе в процентах являются кислород (85,84%), водород (10,82%), хлор (1,94%), натрий (1,08%), магний (0,13%), сера (0,09%), кальций (0,04%), калий (0,04%), бром (0,007%), углерод (0,003%) и бор (0,0004%).
Порядок элементов по объемной доле (которая приблизительно равна молекулярной мольной доле) в атмосфере следующий: азот (78,1%), кислород (20,9%), [19] аргон (0,96%), за которыми следуют (в неопределенном порядке) углерод и водород, поскольку водяной пар и углекислый газ, которые представляют большую часть этих двух элементов в воздухе, являются переменными компонентами. Сера, фосфор и все другие элементы присутствуют в значительно меньших пропорциях.
Согласно графику кривой распространенности, аргон, существенный, если не основной компонент атмосферы, вообще не появляется в коре. Это происходит потому, что атмосфера имеет гораздо меньшую массу, чем кора, поэтому аргон, остающийся в коре, вносит небольшой вклад в массовую долю там, в то время как накопление аргона в атмосфере стало достаточно большим, чтобы быть значительным.
Полный список распространенности элементов в городских почвах см. в разделе Распространенность элементов (страница данных)#Городские почвы .

По массе клетки человека на 65–90% состоят из воды (H 2 O), а значительная часть остатка состоит из органических молекул, содержащих углерод. Таким образом, кислород составляет большую часть массы человеческого тела, за ним следует углерод. Почти 99% массы человеческого тела состоит из шести элементов: водорода (H), углерода (C), азота (N), кислорода (O), кальция (Ca) и фосфора (P). Следующие 0,75% состоят из следующих пяти элементов: калия (K), серы (S), хлора (Cl), натрия (Na) и магния (Mg). Только 17 элементов, как известно, необходимы для жизни человека, а один дополнительный элемент (фтор) считается полезным для прочности зубной эмали. Еще несколько микроэлементов могут играть определенную роль в здоровье млекопитающих. Бор и кремний особенно необходимы для растений, но играют неопределенную роль у животных. Элементы алюминий и кремний, хотя и очень распространены в земной коре, заметно редки в организме человека. [20]
Ниже представлена периодическая таблица, в которой указаны питательные элементы. [21]
Корреляции между распространенностью и энергией связи ядра [Название подраздела]