Ароматические соединения или арены обычно относятся к органическим соединениям «с химией, типичной для бензола » и «циклически сопряженным». [1] Слово «ароматический» происходит от прошлой группировки молекул на основе запаха, до того, как были поняты их общие химические свойства. Современное определение ароматических соединений не имеет никакого отношения к их запаху. Ароматические соединения теперь определяются как циклические соединения, удовлетворяющие правилу Хюккеля . Ароматические соединения обладают следующими общими свойствами:
Арены обычно делятся на две категории - бензоиды, которые содержат производное бензола и следуют модели бензольного кольца, и небензоиды, которые содержат другие ароматические циклические производные. Ароматические соединения обычно используются в органическом синтезе и участвуют во многих типах реакций, следующих как за присоединением, так и за удалением, а также за насыщением и деароматизацией.
Гетероарены — это ароматические соединения, в которых по крайней мере одна метиновая или виниленовая (-C= или -CH=CH-) группа заменена гетероатомом : кислородом , азотом или серой . [ 3] Примерами небензольных соединений с ароматическими свойствами являются фуран , гетероциклическое соединение с пятичленным кольцом, включающим один атом кислорода, и пиридин , гетероциклическое соединение с шестичленным кольцом, содержащим один атом азота. Углеводороды без ароматического кольца называются алифатическими . Примерно половина соединений, известных в 2000 году, в той или иной степени описываются как ароматические. [4]



Ароматические соединения широко распространены в природе и промышленности. Основные промышленные ароматические углеводороды — бензол, толуол , ксилол , называемый BTX. Многие биомолекулы имеют фенильные группы, включая так называемые ароматические аминокислоты .


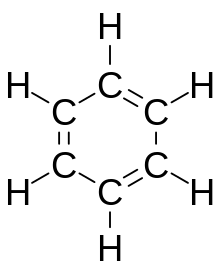
Бензол , C 6 H 6 , является наименее сложным ароматическим углеводородом, и он был первым, определенным как таковой. [6] Его связывающая природа была впервые независимо признана Йозефом Лошмидтом и Августом Кекуле в 19 веке. [6] Каждый атом углерода в гексагональном цикле имеет четыре электрона для совместного использования. Один электрон образует сигма-связь с атомом водорода, а один используется в ковалентной связи с каждым из двух соседних атомов углерода. Это оставляет шесть электронов, равномерно распределенных по кольцу в делокализованных молекулярных орбиталях пи размером с само кольцо. [5] Это представляет эквивалентную природу шести связей углерод-углерод, все из которых имеют порядок связи 1,5. Эту эквивалентность также можно объяснить резонансными формами . [5] Электроны визуализируются как плавающие над и под кольцом, а электромагнитные поля, которые они генерируют, действуют, чтобы удерживать кольцо плоским. [5]
Круговой символ ароматичности был введен сэром Робертом Робинсоном и его учеником Джеймсом Армитом в 1925 году и популяризирован с 1959 года учебником по органической химии Моррисона и Бойда. [7] Правильное использование символа является предметом споров: некоторые публикации используют его для любой циклической π-системы, в то время как другие используют его только для тех π-систем, которые подчиняются правилу Хюккеля . Некоторые утверждают, что для того, чтобы оставаться в соответствии с изначально задуманным предложением Робинсона, использование кругового символа должно быть ограничено моноциклическими 6 π-электронными системами. [8] Таким образом, круговой символ для шестицентровой шестиэлектронной связи можно сравнить с символом Y для трехцентровой двухэлектронной связи . [8]

Производные бензола имеют от одного до шести заместителей , присоединенных к центральному бензольному ядру. [2] Примерами соединений бензола только с одним заместителем являются фенол , который несет гидроксильную группу, и толуол с метильной группой. Когда в кольце присутствует более одного заместителя, их пространственное соотношение становится важным, для чего разрабатываются модели замещения арена орто , мета и пара . [9] При реакции с образованием более сложных производных бензола заместители в бензольном кольце можно описать как активированные или дезактивированные , которые являются электронодонорными и электроноакцепторными соответственно. [9] Активаторы известны как орто-пара-директоры, а дезактиваторы известны как мета-директоры. [9] При реакции заместители будут добавляться в орто, пара или мета-положения в зависимости от направленности текущих заместителей, чтобы сделать более сложные производные бензола, часто с несколькими изомерами. Поток электронов, приводящий к повторной ароматизации, является ключевым фактором обеспечения стабильности таких продуктов. [9]
Например, для крезола существует три изомера , поскольку метильная группа и гидроксильная группа (обе орто-пара-директора) могут располагаться рядом друг с другом ( орто ), на расстоянии одной позиции друг от друга ( мета ) или на расстоянии двух позиций друг от друга ( пара ). [10] Учитывая, что и метильная, и гидроксильная группы являются орто-пара-директорами, орто- и пара-изомеры обычно являются предпочтительными. [10] Ксиленол имеет две метильные группы в дополнение к гидроксильной группе, и для этой структуры существует 6 изомеров. [ требуется цитата ]
Кольца аренов могут стабилизировать заряды, как это видно, например, в феноле (C 6 H 5 –OH), который является кислотным на гидроксиле (OH), поскольку заряд на кислороде (алкоксид –O − ) частично делокализован в бензольном кольце.
Хотя бензиловые арены распространены, небензиловые соединения также чрезвычайно важны. Любое соединение, содержащее циклическую часть, которая соответствует правилу Хюккеля и не является производным бензола, можно считать небензиловым ароматическим соединением. [5]
Из аннуленов , больших, чем бензол, [12]аннулен и [14]аннулен являются слабоароматическими соединениями, а [18]аннулен, циклооктадеканонаен , является ароматическим, хотя напряжение внутри структуры вызывает небольшое отклонение от точно плоской структуры, необходимой для ароматической категоризации. [11] Другим примером небензильного моноциклического арена является циклопропенил (циклопропениевый катион), который удовлетворяет правилу Хюккеля с n, равным 0. [12] Обратите внимание, что только катионная форма этого циклического пропенила является ароматической, учитывая, что нейтральность в этом соединении нарушила бы либо правило октета, либо правило Хюккеля . [12]
Другие небензильные моноциклические арены включают вышеупомянутые гетероарены, которые могут заменять атомы углерода другими гетероатомами, такими как N, O или S. [5] Распространенными примерами таких соединений являются шестичленный пиррол и пятичленный пиридин , оба из которых имеют замещенный азот [13]
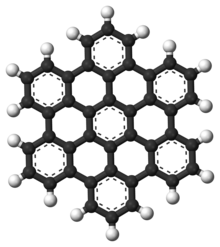
Полициклические ароматические углеводороды , также известные как многоядерные ароматические соединения (ПАУ), представляют собой ароматические углеводороды, которые состоят из конденсированных ароматических колец и не содержат гетероатомов или несут заместители . [14] Нафталин является простейшим примером ПАУ. ПАУ встречаются в нефтяных , угольных и смоляных отложениях и производятся как побочные продукты сжигания топлива (будь то ископаемое топливо или биомасса). [15] Как загрязнители, они вызывают беспокойство, поскольку некоторые соединения были идентифицированы как канцерогенные , мутагенные и тератогенные . [16] [17] [18] [19] ПАУ также обнаруживаются в приготовленных продуктах. [15] Исследования показали, что высокие уровни ПАУ обнаруживаются, например, в мясе, приготовленном при высоких температурах, например, на гриле или барбекю, и в копченой рыбе. [15] [16] Они также являются хорошими молекулами-кандидатами, которые могут служить основой для самых ранних форм жизни . [20] В графене мотив ПАУ распространяется на большие двумерные листы. [21]
Ароматические кольцевые системы участвуют во многих органических реакциях.
При ароматическом замещении один заместитель в кольце арена, обычно водород, заменяется другим реагентом. [5] Два основных типа — электрофильное ароматическое замещение , когда активным реагентом является электрофил, и нуклеофильное ароматическое замещение , когда реагентом является нуклеофил. При радикально-нуклеофильном ароматическом замещении активным реагентом является радикал . [22] [23]
Примером электрофильного ароматического замещения является нитрование салициловой кислоты , где нитрогруппа присоединяется в пара-положение к гидроксильному заместителю:

Нуклеофильное ароматическое замещение включает в себя перемещение уходящей группы , например галогенида , на ароматическом кольце . Ароматические кольца обычно нуклеофильны, но в присутствии электроноакцепторных групп ароматические соединения подвергаются нуклеофильному замещению. Механистически эта реакция отличается от обычной реакции S N 2 , поскольку она происходит на тригональном атоме углерода ( гибридизация sp 2 ). [24]
Гидрирование аренов создает насыщенные кольца. Соединение 1-нафтол полностью восстанавливается до смеси изомеров декалин -ола . [25]
Соединение резорцин , гидрогенизированное никелем Ренея в присутствии водного раствора гидроксида натрия, образует енолят , который алкилируется метилиодидом до 2-метил-1,3-циклогександиона: [26]
В реакциях деароматизации теряется ароматичность реагента. В этом отношении деароматизация связана с гидрированием. Классический подход — восстановление по Берчу . Методология используется в синтезе. [27]
