
В стереохимии стереоизомерия или пространственная изомерия — это форма изомерии , при которой молекулы имеют одинаковую молекулярную формулу и последовательность связанных атомов (конституцию), но различаются трехмерной ориентацией своих атомов в пространстве. [1] [2] Это контрастирует со структурными изомерами , которые имеют одинаковую молекулярную формулу, но связи или их порядок различаются. По определению, молекулы, которые являются стереоизомерами друг друга, представляют собой один и тот же структурный изомер. [3]
Энантиомеры , также известные как оптические изомеры , представляют собой два стереоизомера, которые связаны друг с другом отражением: они являются зеркальными отображениями друг друга, которые не накладываются друг на друга. Человеческие руки являются макроскопическим аналогом этого. Каждый стереогенный центр в одном имеет противоположную конфигурацию в другом. Два соединения, которые являются энантиомерами друг друга, имеют одинаковые физические свойства, за исключением направления, в котором они вращают поляризованный свет , и того, как они взаимодействуют с различными энантиомерами других соединений. В результате различные энантиомеры соединения могут иметь существенно различные биологические эффекты. Чистые энантиомеры также проявляют явление оптической активности и могут быть разделены только с использованием хирального агента. В природе присутствует только один энантиомер большинства хиральных биологических соединений, таких как аминокислоты (за исключением глицина , который является ахиральным). Оптически активное соединение показывает две формы: форму D -(+) и форму L -(−).
Диастереомеры — это стереоизомеры, не связанные посредством операции отражения. [4] Они не являются зеркальными отражениями друг друга. К ним относятся мезосоединения , цис - транс -изомеры , EZ-изомеры и неэнантиомерные оптические изомеры . Диастереомеры редко обладают одинаковыми физическими свойствами. В примере, показанном ниже, мезоформа винной кислоты образует диастереомерную пару как с лево-, так и с правовинной кислотами, которые образуют энантиомерную пару.
Маркировка D- и L- изомеров, представленная выше, не совпадает с более распространенной маркировкой d- и l- , что объясняет, почему они могут показаться перевернутыми тем, кто знаком только с последней системой обозначений.
Проекция Фишера может использоваться для различения L- и D-молекул Хиральность (химия) . Например, по определению, в проекции Фишера предпоследний углерод D-сахаров изображается с водородом слева и гидроксилом справа. L-сахара будут показаны с водородом справа и гидроксилом слева.
Другой относится к оптическому вращению , при взгляде на источник света вращение плоскости поляризации может быть либо правым (правовращательным — d-вращательным, представленным (+), по часовой стрелке), либо левым (левовращательным — l-вращательным, представленным (−), против часовой стрелки) в зависимости от того, какой стереоизомер доминирует. Например, сахароза и камфора являются d-вращательными, тогда как холестерин является l-вращательным.
Стереоизомерия вокруг двойных связей возникает из-за того, что вращение вокруг двойной связи ограничено, что сохраняет заместители фиксированными относительно друг друга. [5] Если два заместителя хотя бы на одном конце двойной связи одинаковы, то стереоизомера нет, и двойная связь не является стереоцентром, например, пропен, CH 3 CH=CH 2 , где оба заместителя на одном конце — это H. [6]
Традиционно стереохимия двойной связи описывалась как цис (лат., с этой стороны) или транс (лат., поперек), в зависимости от относительного положения заместителей по обе стороны от двойной связи. Простым примером цис - транс -изомерии являются 1,2-дизамещенные этены, такие как изомеры дихлорэтена (C 2 H 2 Cl 2 ), показанные ниже. [7]
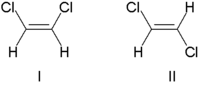
Молекула I представляет собой цис -1,2-дихлорэтен, а молекула II представляет собой транс -1,2-дихлорэтен. Из-за возникающей неоднозначности ИЮПАК принял более строгую систему, в которой заместителям на каждом конце двойной связи присваивается приоритет на основе их атомного номера . Если заместители с высоким приоритетом находятся на одной стороне связи, им присваивается Z (нем. zusammen , вместе). Если они находятся на противоположных сторонах, им присваивается E (нем. entgegen , напротив). [8] Поскольку у хлора атомный номер больше, чем у водорода, он является группой с наивысшим приоритетом. [9] Используя эту нотацию для обозначения изображенных выше молекул, молекула I представляет собой ( Z )-1,2-дихлорэтен, а молекула II представляет собой ( E )-1,2-дихлорэтен. Z и цис или E и транс не всегда взаимозаменяемы. Рассмотрим следующий фторметилпентен:
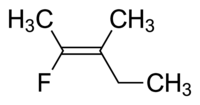
Правильное название этой молекулы — транс -2-фтор-3-метилпент-2-ен, потому что алкильные группы, образующие основную цепь (т. е. метил и этил), находятся поперек двойной связи друг от друга, или ( Z )-2-фтор-3-метилпент-2-ен, потому что группы с наивысшим приоритетом по обе стороны двойной связи находятся по одну и ту же сторону двойной связи. Фтор — это группа с наивысшим приоритетом по левую сторону двойной связи, а этил — это группа с наивысшим приоритетом по правую сторону молекулы.
Термины цис и транс также используются для описания относительного положения двух заместителей в кольце: цис, если на одной стороне, в противном случае транс . [10] [11]
Конформационная изомерия — это форма изомерии, которая описывает явление молекул с одинаковой структурной формулой, но с разной формой из-за вращений вокруг одной или нескольких связей. [12] [13] [14] Различные конформации могут иметь разную энергию, обычно могут взаимопревращаться и очень редко могут быть изолированы. Например, существует множество конформаций циклогексана (циклогексан является существенным промежуточным продуктом для синтеза нейлона-6,6), включая конформацию кресла , где четыре атома углерода образуют «сиденье» кресла, один атом углерода — «спинка» кресла, а один атом углерода — «подставка для ног»; и конформацию лодки , конформация лодки представляет собой максимум энергии на конформационном маршруте между двумя эквивалентными формами кресла; однако она не представляет собой переходное состояние для этого процесса, поскольку существуют пути с более низкой энергией. Конформационная инверсия замещенных циклогексанов — очень быстрый процесс при комнатной температуре с периодом полураспада 0,00001 секунды. [15] [16]
Некоторые молекулы могут быть изолированы в нескольких конформациях из-за больших энергетических барьеров между различными конформациями. 2,2',6,6'-Тетразамещенные бифенилы могут вписываться в эту последнюю категорию.
Аномерия — это идентичность для структур колец с одинарной связью, где «цис» или «Z» и «транс» или «E» (геометрическая изомерия) необходимо назвать замещения на атоме углерода, который также отображает идентичность хиральности; поэтому аномеры имеют атомы углерода, которые имеют геометрическую изомерию и оптическую изомерию ( энантиомерию ) на одном или нескольких атомах углерода кольца. [17] [18] [19] [20] Аномеры называются «альфа» или «аксиальными» и «бета» или «экваториальными» при замещении циклической кольцевой структуры, которая имеет одинарные связи между атомами углерода кольца, например, гидроксильной группой, метилгидроксильной группой, метоксигруппой или другой пиранозной или фуранозной группой, которые являются типичными замещениями одинарных связей, но не ограничиваются ими. [21] Аксиальная геометрическая изомерия будет перпендикулярна (90 градусов) к плоскости отсчета, а экваториальная будет находиться на расстоянии 120 градусов от аксиальной связи или отклоняться на 30 градусов от плоскости отсчета. [22]
Атропоизомеры — это стереоизомеры, возникающие в результате затрудненного вращения вокруг одинарных связей , где стерический барьер напряжения для вращения достаточно высок, чтобы обеспечить изоляцию конформеров. [23] [24]
Правило Ле Бель-Вант-Гоффа гласит, что для структуры с n асимметричными атомами углерода существует максимум 2 n различных стереоизомеров. Например, D -глюкоза является альдогексозой и имеет формулу C 6 H 12 O 6 . Четыре из ее шести атомов углерода являются стереогенными, что означает, что D -глюкоза является одним из 2 4 =16 возможных стереоизомеров. [25] [26]