Микотоксин T-2 — это трихотеценовый микотоксин . Это естественный побочный продукт плесени грибка Fusarium spp. , который токсичен для людей и других животных. Клиническое состояние, которое он вызывает, — это алиментарная токсическая алейкия и множество симптомов, связанных с такими разнообразными органами, как кожа, дыхательные пути и желудок. Попадание в организм может происходить при употреблении заплесневелых цельных зерен . T-2 может всасываться через кожу человека. [2] Хотя никаких существенных системных эффектов после контакта с кожей в обычных сельскохозяйственных или жилых условиях не ожидается , нельзя исключать местные кожные эффекты. Следовательно, контакт кожи с T-2 должен быть ограничен.
Алиментарная токсическая алейкия (АТА), болезнь, вызываемая трихотеценами, такими как микотоксин Т-2, убила многие тысячи граждан СССР в Оренбургской области в 1940-х годах. Сообщалось, что уровень смертности составил 10% от всего населения в этой области. В 1970-х годах было высказано предположение, что причиной этого массового отравления стало употребление зараженной пищи. Из-за Второй мировой войны сбор урожая зерновых задерживался, и в России ощущался дефицит продовольствия. Это привело к потреблению зерна, зараженного плесенью Fusarium , которая вырабатывает микотоксин Т-2. [3]
В 1981 году государственный секретарь США Александр Хейг и его преемник Джордж П. Шульц обвинили Советский Союз в использовании микотоксина Т-2 в качестве химического оружия, известного как « желтый дождь » в Лаосе (1975–81), Кампучии (1979–81) и Афганистане (1979–81), где он якобы стал причиной тысяч жертв. [4] Хотя несколько американских экспертов по химическому оружию утверждают, что идентифицировали образцы «желтого дождя» из Лаоса как трихотецены, другие эксперты полагают, что это воздействие было вызвано естественным микотоксином Т-2 в загрязненных продуктах питания. [5] Другая альтернативная теория была разработана биологом из Гарварда Мэтью Месельсоном , который предположил, что «желтый дождь», обнаруженный в Юго-Восточной Азии, произошел от экскрементов пчел джунглей. [6] Первым указанием на эту теорию стало обнаружение высокого уровня пыльцы в собранных образцах, что придало веществу желтый цвет. Было также обнаружено, что пчелы джунглей в этом районе летают коллективно в больших количествах на слишком больших высотах, чтобы их можно было легко увидеть, производя потоки фекалий, которые можно было бы ошибочно принять за брызги с самолета. [7] Дальнейшие испытания позже показали, что маслянистая жидкость на самом деле была наполненными пыльцой фекалиями пчел джунглей. [6] Похожий случай был выявлен в Китае, и в этом случае причиной явления также были экскременты пчел. [8] Несмотря на этот убедительный анализ, Соединенные Штаты не отозвали свои обвинения и заявляют, что проблема не была полностью решена.
Микотоксин Т-2 также считается причиной синдрома войны в Персидском заливе . Американские войска страдали от симптомов, похожих на микотоксикоз, после того, как иракская ракета взорвалась в военном лагере США в Саудовской Аравии во время операции «Буря в пустыне» в войне в Персидском заливе в 1991 году. Было показано, что Ирак исследовал трихотеценовые микотоксины, среди других веществ, и, таким образом, был способен обладать ими и использовать в химической войне . Тем не менее, большая часть ключевой информации об этих инцидентах остается засекреченной, оставляя эти вопросы до сих пор нерешенными. [9]
Это соединение имеет тетрациклическую сесквитерпеноидную 12,13-эпокситрихотеновую кольцевую систему, которая роднит его с трихотеценами. [10] Эти соединения, как правило, очень стабильны и не разрушаются во время хранения/измельчения и приготовления/обработки пищи. Они также не разрушаются при высоких температурах. Это соединение имеет эпоксидное кольцо и несколько ацетильных и гидроксильных групп на его боковых цепях. Эти особенности в основном отвечают за биологическую активность соединения и делают его высокотоксичным. Микотоксин T-2 способен ингибировать синтез ДНК и РНК in vivo и in vitro [11] и может вызывать апоптоз . [12] Однако in vivo соединение быстро метаболизируется в микотоксин HT-2 (основной метаболит ). [13]
Токсичность токсина Т-2 обусловлена его 12,13-эпоксидным кольцом. [14] Эпоксиды в целом являются токсичными соединениями; они реагируют с нуклеофилами , а затем подвергаются дальнейшим ферментативным реакциям . Реакционная способность эпоксидов может приводить к реакциям с эндогенными соединениями и клеточными компонентами, такими как основания ДНК и белки. [15] Эти реакции могут быть причиной отмеченных действий и эффектов микотоксина Т-2. Токсичное соединение влияет на метаболизм мембранных фосфолипидов , приводит к увеличению липидных пероксидаз печени и оказывает ингибирующее действие на синтез ДНК и РНК. Кроме того, оно может связываться с неотъемлемой частью 60-й рибосомальной субъединицы, пептидилтрансферазы , тем самым ингибируя синтез белка . Считается, что эти эффекты объясняют апоптоз (смерть клеток) токсина Т-2 в различных тканях, таких как иммунная система , желудочно-кишечная ткань, а также ткань плода. Что касается апоптоза, то было отмечено, что уровень проапоптотического фактора Bas (Bcl-2-ассоциированный белок X) был повышен, а уровень Bcl-xl, антиапоптотического фактора, был снижен в человеческих хондроцитах ( хрящевых клетках). При воздействии микотоксина T-2. Кроме того, был повышен уровень Fas, связанного с апоптозом антигена клеточной поверхности, и p53, белка, регулирующего клеточный цикл.
Микотоксин Т-2 вырабатывается естественным образом грибами Fusarium, наиболее важными видами которых являются: F. sporotrichioides , F. langsethiae , F. acuminatum и F. poae . Эти грибы встречаются в зерновых, таких как ячмень , пшеница и овес . Производство этого соединения для исследовательских и коммерческих целей обычно осуществляется путем культивирования некоторого штамма грибов, продуцирующих микотоксин Т-2, на агаровых пластинах . На этих агаровых пластинах грибы выглядят порошкообразными и могут выделять значительные количества микотоксина Т-2. Для выделения соединения обычно используется жидкостная хроматография высокого давления (ВЭЖХ). [16]
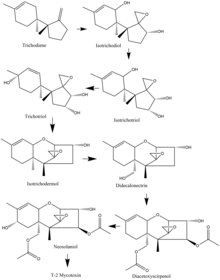
У видов Fusarium биосинтез микотоксина Т-2 часто начинается с триходиена, и многие виды имеют общий путь окисления и циклизации . Например, у видов F. sporotrichioides важные этапы окисления начинаются с триходиена и переходят в изотриходиол. Оттуда одиннадцатый атом углерода окисляется с образованием изотрихотриола. Затем окисляется девятый углерод, и образуется трихотриол, который затем циклизуется с образованием изотриходермола. После этого пятнадцатый углерод окисляется с образованием дидекалонектрина, что приводит к окислению четвертого углерода и образованию диацетоксисцирпенола. Предпоследний этап — окисление восьмого углерода с образованием неосоланиола, который затем претерпевает небольшую модификацию с образованием токсина Т-2. [17]
Люди и животные обычно подвергаются воздействию микотоксинов Т-2 через пищу. Некоторые виды зерна могут содержать токсин, что делает его угрозой для здоровья человека и экономическим бременем. [18] В отличие от большинства биологических токсинов микотоксин Т-2 может всасываться через неповрежденную кожу. Соединение может поступать через пищу, воду, капли, аэрозоли и дым из различных систем рассеивания. Это делает его потенциальным биологическим оружием , однако для летальной дозы требуются большие количества соединения . Микотоксин Т-2 имеет LD 50 приблизительно 1 миллиграмм на килограмм веса тела.
По оценкам EFSA , средний уровень воздействия T-2 в ЕС составляет от 12 до 43 нг/кг массы тела в день. [19] Этот диапазон ниже TDI в 100 нг/кг массы тела для суммы токсинов HT-2 и T-2, которая используется EFSA.
Микотоксин Т-2 равномерно распределяется по всему телу без предпочтения к определенному органу или участку. У грызунов уровни концентрации в плазме достигают пика примерно через тридцать минут после воздействия, и в одном исследовании период полураспада токсина Т-2 составил менее двадцати минут. В другом исследовании с участием свиней распределение после четырех часов внутривенной инъекции составило 15–24% в желудочно-кишечном тракте и 4,7–5,2% в различных других тканях. [20]
После абсорбции и распределения в различных тканях микотоксин Т-2 проходит через различные метаболические реакции, прежде чем он будет выведен. Исследования in vivo показали, что наиболее часто встречающимися реакциями являются гидролиз эфира и гидроксилирование изовалериановой группы. Также происходит деэпоксидация и конъюгация глюкуронида . Ht-2 является основным метаболитом. Предполагается, что в гидроксилировании участвует комплекс ферментов цитохрома p450. T-2 триол и T-2 тетраол, скорее всего, образуются с помощью ацетилхолинэстераз . Некоторые из метаболических реакций микотоксина осуществляются микрофлорой кишечника . Образующиеся метаболиты в этих реакциях зависят от вида и pH. Однако расщепление эфира осуществляется самим млекопитающим, а не микрофлорой. В эритроцитах микотоксин Т-2 метаболизируется в неосоланиол, а в лейкоцитах — в HT-2 посредством гидролиза, катализируемого карбоксилэстеразами.
После абсорбции, распределения и метаболизма микотоксин Т-2 выводится довольно быстро, причем 80–90% его выводится в течение 48 часов. [20] Основными способами выведения, по-видимому, являются моча и кал, [21] где выведение через желчь вносит большой вклад в путь выведения с калом. [14] В выделениях также содержится очень мало исходного микотоксина Т-2, что означает, что большая часть исходного соединения метаболизируется заранее. [21]
T-2 очень токсичен при вдыхании. Симптомы острого отравления включают рвоту, диарею, раздражение кожи, зуд, сыпь, волдыри, кровотечение и одышку . [ необходима цитата ] Если человек подвергается воздействию T-2 в течение длительного периода, развивается алиментарно-токсическая алейкия (ATA).
Сначала пациент испытывает жжение во рту, горле и желудке. Через несколько дней человек страдает от острого гастроэнтерита , который продлится от 3 до 9 дней. В течение 9 недель костный мозг медленно дегенерирует. Также кожа начинает кровоточить, а общее количество лейкоцитов уменьшается. Могут возникнуть проблемы с нервной системой.
В конце концов могут возникнуть следующие симптомы: высокая температура, петехиальное кровоизлияние , некроз мышц и кожи, бактериальные инфекции некротических тканей, увеличенные лимфатические узлы . Существует вероятность асфиксии из-за отека гортани и стеноза голосовой щели . Нехватка кислорода является тогда причиной смерти. В противном случае пациент умрет от бронхиальной пневмонии и легочного кровотечения. [22]
Микотоксин Т-2 также токсичен для животных. Известно, что это соединение оказывает летальное и сублетальное воздействие на сельскохозяйственных животных. Его часто обнаруживают в загрязненных злаковых зернах, которые скармливают этим животным. [23] Большинство токсических эффектов распределяются между людьми и животными. После воздействия на эмбрионы зебры концентрации 20 мкмоль/л или выше увеличились показатели пороков развития и смертности . Пороки развития включали деформации хвоста, сердечно-сосудистые дефекты и изменения в поведении на ранних стадиях жизни. Это является результатом увеличения количества эпоксидов, которые вызывают апоптоз клеток. [24] Другие исследования показали, что Т-2-токсин вызывает перекисное окисление липидов у крыс после кормления их ими. В качестве эффекта Т-2-токсина у нескольких видов млекопитающих наблюдались повышенные уровни активных форм кислорода (ROS). Однако, несмотря на общие вредные эффекты, вызванные токсином, в исследовании, проведенном на различных моделях культуры клеток печени, полученных от кур, не было обнаружено никаких изменений в окислительно-восстановительном статусе клеток. [25]
Соединение также, по-видимому, снижает плодовитость овец и телок. Исследования показали, что высокая доза Т-2 задерживает овуляцию из -за задержки созревания фолликула . Это, возможно, задерживает последующую лютеинизацию , что делает невозможным зачатие самок животных.
T-2 также влияет на плодовитость быков. В 1998 году было обнаружено, что заплесневелое сено влияет на качество спермы быков. Анализ заплесневелого сена показал, что T-2 присутствует. Соединение снижает подвижность сперматозоидов и уровень тестостерона, а также увеличивает частоту морфологических аномалий в сперматозоидах.
Печень является еще одной целью микотоксина. Это один из первых органов, через который проходит соединение после приема внутрь. Здесь оно вызывает снижение экспрессии белков CYP1A у кроликов, свиней и крыс. Активность CYP3A также снижается у свиней. Эти ферменты помогают метаболизировать лекарства, которые проходят через печень. Снижение активности может привести к увеличению неметаболизированных лекарств в плазме. Это может иметь опасные последствия для здоровья животного. [26]
Все упомянутые эффекты возникают при приеме Т-2 в высоких дозах. Животные способны метаболизировать соединение с помощью ферментов семейства CYP3A, как и люди.
На данный момент не существует специфической терапии отравлений микотоксинами Т-2. [21] Воздействие микотоксина обычно сопровождается стандартизированным лечением токсичных соединений с целью снижения эффекта токсина. Это включает использование активированного угля , который имеет высокую связывающую способность 0,48 мг микотоксина Т-2 на 1 мг угля. [21] При контакте с кожей используются мыло и вода для снижения дермальных эффектов. [21] В качестве своего рода профилактики , антиоксиданты , как полагают, обладают свойствами, которые могут принести пользу. [20]
В настоящее время нет приложений, кроме военных, для микотоксинов Т-2; однако есть некоторые правдоподобные терапевтические применения. Благодаря их способностям, исследования показывают возможные применения микотоксина в качестве стимуляторов роста, антибиотиков , противовирусных средств , как противолейкемических и противомалярийных средств . [20]
Желтый дождь — это экскременты пчел джунглей. Он желтый от переваренных зерен пыльцы, и он падает с роев пчел слишком высоко, чтобы его можно было увидеть. Его теория оказывается совершенно верной. Собственные исследования правительства, все еще неопубликованные, доказывают, что источником являются пчелы, а не бомбы.