Потентность клеток — это способность клеток дифференцироваться в другие типы клеток. [1] [2] Чем больше типов клеток может дифференцироваться клетка, тем выше ее потенция. Потентность также описывается как потенциал активации генов внутри клетки, который, как континуум, начинается с тотипотентности, чтобы обозначить клетку с наибольшим потенциалом дифференциации, плюрипотентности , мультипотентности , олигопотентности и, наконец, унипотентности .

Тотипотентность (лат. totipotentia , букв. «способность ко всему») — это способность одной клетки делиться и производить все дифференцированные клетки в организме . Примерами тотипотентных клеток являются споры и зиготы . [3] В спектре клеточной потенции тотипотентность представляет собой клетку с наибольшим потенциалом дифференциации , способную дифференцироваться в любую эмбриональную клетку, а также в любую внеэмбриональную клетку ткани . Напротив, плюрипотентные клетки могут дифференцироваться только в эмбриональные клетки. [4] [5]
Полностью дифференцированная клетка может вернуться в состояние тотипотентности. [6] Преобразование в тотипотентность является сложным и не до конца изученным. В 2011 году исследования показали, что клетки могут дифференцироваться не в полностью тотипотентную клетку, а вместо этого в «сложную клеточную вариацию» тотипотентности. [7]
Модель развития человека может быть использована для описания того, как возникают тотипотентные клетки. [8] Развитие человека начинается, когда сперматозоид оплодотворяет яйцеклетку, и полученная оплодотворенная яйцеклетка создает одну тотипотентную клетку, зиготу . [9] В первые часы после оплодотворения эта зигота делится на идентичные тотипотентные клетки, которые впоследствии могут развиться в любой из трех зародышевых листков человека ( энтодерм , мезодерм или эктодерм ) или в клетки плаценты ( цитотрофобласт или синцитиотрофобласт ). Достигнув 16-клеточной стадии, тотипотентные клетки морулы дифференцируются в клетки, которые в конечном итоге станут либо внутренней клеточной массой бластоцисты , либо внешними трофобластами . Примерно через четыре дня после оплодотворения и после нескольких циклов клеточного деления эти тотипотентные клетки начинают специализироваться. Внутренняя клеточная масса, источник эмбриональных стволовых клеток , становится плюрипотентной.
Исследования Caenorhabditis elegans показывают, что множественные механизмы, включая регуляцию РНК, могут играть роль в поддержании тотипотентности на разных стадиях развития у некоторых видов. [10] Исследования с данио-рерио и млекопитающими показывают дальнейшее взаимодействие между микроРНК и РНК-связывающими белками (RBP) в определении различий в развитии. [11]
В первичных зародышевых клетках мыши перепрограммирование по всему геному , приводящее к тотипотентности, включает стирание эпигенетических импринтов. Перепрограммирование облегчается активным деметилированием ДНК , включающим ферментативный путь репарации эксцизионных оснований ДНК . [12] Этот путь влечет за собой стирание метилирования CpG (5mC) в первичных зародышевых клетках посредством первоначального превращения 5mC в 5-гидроксиметилцитозин (5hmC), реакция, вызванная высокими уровнями ферментов диоксигеназы ten-eleven TET-1 и TET-2 . [13]
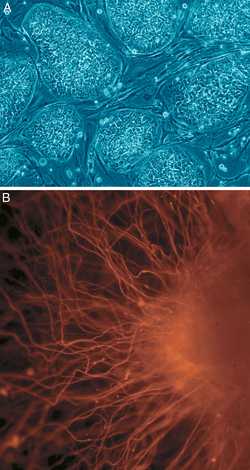
В клеточной биологии плюрипотентность (лат. pluripotentia , букв. «способность ко многим [вещам]») [14] относится к стволовой клетке, которая имеет потенциал дифференцироваться в любой из трех зародышевых слоев : энтодерм (кишечник, легкие и печень), мезодерм (мышцы, скелет, кровеносные сосуды, мочеполовая система, дерма) или эктодерм (нервная, сенсорная, эпидермис), но не во внеэмбриональные ткани, такие как плацента или желточный мешок. [15]
Индуцированные плюрипотентные стволовые клетки, обычно сокращенно называемые iPS-клетками или iPSC, представляют собой тип плюрипотентных стволовых клеток, искусственно полученных из неплюрипотентной клетки, как правило, взрослой соматической клетки , путем индукции «принудительной» экспрессии определенных генов и факторов транскрипции . [16] Эти факторы транскрипции играют ключевую роль в определении состояния этих клеток, а также подчеркивают тот факт, что эти соматические клетки сохраняют ту же генетическую информацию, что и ранние эмбриональные клетки. [17] Способность индуцировать клетки в плюрипотентное состояние была первоначально исследована в 2006 году с использованием мышиных фибробластов и четырех факторов транскрипции, Oct4 , Sox2 , Klf4 и c- Myc ; [18] эта техника, называемая перепрограммированием , позже принесла Шинья Яманаке и Джону Гердону Нобелевскую премию по физиологии и медицине. [19] Затем в 2007 году последовала успешная индукция человеческих iPSC, полученных из человеческих дермальных фибробластов с использованием методов, аналогичных тем, которые использовались для индукции клеток мыши. [20] Эти индуцированные клетки демонстрируют схожие черты с эмбриональными стволовыми клетками (ESC), но не требуют использования эмбрионов. Некоторые из сходств между ESC и iPSC включают плюрипотентность, морфологию , способность к самообновлению, черту, которая подразумевает, что они могут делиться и реплицироваться бесконечно, и экспрессию генов . [21]
Эпигенетические факторы также считаются вовлеченными в фактическое перепрограммирование соматических клеток с целью индукции плюрипотентности. Было высказано предположение, что определенные эпигенетические факторы могут фактически работать для очистки исходных соматических эпигенетических меток с целью приобретения новых эпигенетических меток, которые являются частью достижения плюрипотентного состояния. Хроматин также реорганизуется в iPSC и становится похожим на тот, что находится в ESC, в том смысле, что он менее конденсирован и, следовательно, более доступен. Также распространены модификации эухроматина , что также согласуется с состоянием эухроматина, обнаруженным в ESC. [21]
Из-за их большого сходства с ESC медицинские и исследовательские сообщества интересуются iPSC. iPSC потенциально могут иметь те же терапевтические последствия и приложения, что и ESC, но без спорного использования эмбрионов в этом процессе, что является предметом больших биоэтических дебатов. Индуцированная плюрипотентность соматических клеток в недифференцированные iPS-клетки изначально приветствовалась как конец спорного использования эмбриональных стволовых клеток . Однако было обнаружено, что iPSC потенциально онкогенны , и, несмотря на достижения, [16] никогда не были одобрены для клинических исследований в Соединенных Штатах до недавнего времени. В настоящее время аутологичные дофаминергические клетки-предшественники, полученные из iPSC, используются в испытаниях для лечения болезни Паркинсона. [22] При создании iPSC также возникли такие недостатки, как низкие показатели репликации и раннее старение, [23] что затрудняет их использование в качестве замены ESC.
Соматическая экспрессия комбинированных факторов транскрипции может напрямую индуцировать другие определенные судьбы соматических клеток ( трансдифференцировку ); исследователи идентифицировали три специфичных для нейронной линии фактора транскрипции, которые могут напрямую преобразовывать мышиные фибробласты (клетки соединительной ткани) в полностью функциональные нейроны . [24] Этот результат ставит под сомнение конечную природу клеточной дифференциации и целостность приверженности линии; и подразумевает, что при наличии соответствующих инструментов все клетки являются тотипотентными и могут образовывать все виды тканей.
Некоторые из возможных медицинских и терапевтических применений iPSC, полученных от пациентов, включают их использование в трансплантациях клеток и тканей без риска отторжения, который обычно встречается. iPSC потенциально могут заменить неподходящие модели животных, а также модели in vitro, используемые для исследования заболеваний. [25]

Результаты, касающиеся эпибластов до и после имплантации, привели к предложениям по классификации плюрипотентности в двух состояниях: «наивный» и «примированный», представляющих эпибласт до и после имплантации соответственно. [26] Континуум от наивного к примированному контролируется снижением димеризации Sox2/Oct4 на элементах ДНК SoxOct, контролирующих наивную плюрипотентность. [27] Примированные плюрипотентные стволовые клетки разных видов можно вернуть в наивное состояние с помощью коктейля, содержащего Klf4 и Sox2 или «супер-Sox» — химерный фактор транскрипции с повышенной способностью к димеризации с Oct4. [27]
Базовые стволовые клетки, обычно используемые в науке, которые называются эмбриональными стволовыми клетками (ЭСК), происходят из предимплантационного эпибласта; такой эпибласт способен генерировать весь плод, и одна клетка эпибласта способна вносить вклад во все клеточные линии, если ее ввести в другую бластоцисту. С другой стороны, можно наблюдать несколько заметных различий между предимплантационными и постимплантационными эпибластами, например, их различие в морфологии, при котором эпибласт после имплантации меняет свою морфологию на чашеобразную форму, называемую «яичным цилиндром», а также хромосомное изменение, при котором одна из Х-хромосом подвергается случайной инактивации на ранней стадии яичного цилиндра, известной как Х-инактивация . [28] В ходе этого развития клетки эпибласта яйцевого цилиндра систематически подвергаются воздействию факторов роста фибробластов , сигналов Wnt и других индуктивных факторов через окружающий желточный мешок и ткань трофобласта [29] , в результате чего они становятся инструктивно специфичными в соответствии с пространственной организацией. [30]
Другим важным отличием является то, что постимплантационные эпибластные стволовые клетки не способны вносить вклад в химеры бластоцисты [31] , что отличает их от других известных плюрипотентных стволовых клеток. Клеточные линии, полученные из таких постимплантационных эпибластов, называются эпибластными стволовыми клетками , которые впервые были получены в лаборатории в 2007 году. Как ESC, так и EpiSC происходят из эпибластов, но на разных фазах развития. Плюрипотентность все еще сохраняется в постимплантационном эпибласте, о чем свидетельствует сохраненная экспрессия Nanog , Fut4 и Oct-4 в EpiSC [32] до сомитогенеза и может быть отменена на полпути через индуцированную экспрессию Oct-4 [33] .
_Ranunculus_asiaticus_-_example_of_Totipotency.jpg/440px-(MHNT)_Ranunculus_asiaticus_-_example_of_Totipotency.jpg)
Неиндуцированная плюрипотентность наблюдалась в культуре тканей корневой меристемы, особенно Каримом и др. 2015 г., Кимом и др. 2018 г. и Росспопоффом и др. 2017 г. Эта плюрипотентность регулируется различными регуляторами, включая PLETHORA 1 и PLETHORA 2 ; а также PLETHORA 3 , PLETHORA 5 и PLETHORA 7 , экспрессия которых, как обнаружил Карим, провоцируется ауксином . (Они также известны как PLT1, PLT2, PLT3, PLT5, PLT7 и экспрессируются генами с теми же названиями.) Ожидается, что с 2019 г. [обновлять]это откроет новые возможности для будущих исследований плюрипотентности в тканях корней. [34]

Мультипотентность — это когда клетки-предшественники имеют потенциал активации генов для дифференциации в отдельные типы клеток. Например, гемопоэтическая стволовая клетка — и этот тип клеток может дифференцироваться в несколько типов клеток крови, таких как лимфоциты , моноциты , нейтрофилы и т. д., но все еще неясно, обладают ли HSC способностью дифференцироваться в клетки мозга , костные клетки или другие типы клеток, не являющиеся клетками крови. [ требуется цитата ]
Исследования, связанные с мультипотентными клетками, показывают, что мультипотентные клетки могут быть способны к преобразованию в неродственные типы клеток. В другом случае стволовые клетки пуповинной крови человека были преобразованы в человеческие нейроны. [35] Также есть исследования по преобразованию мультипотентных клеток в плюрипотентные клетки. [36]
Мультипотентные клетки обнаружены во многих, но не во всех типах клеток человека. Мультипотентные клетки были обнаружены в пуповинной крови , [37] жировой ткани, [38] сердечных клетках, [39] костном мозге и мезенхимальных стволовых клетках (МСК), которые обнаружены в третьем моляре . [40]
МСК могут оказаться ценным источником стволовых клеток из моляров в возрасте 8–10 лет, до кальцификации зубов у взрослых. МСК могут дифференцироваться в остеобласты, хондроциты и адипоциты. [41]
В биологии олигопотентность — это способность клеток-предшественников дифференцироваться в несколько типов клеток . Это степень потенции . Примерами олигопотентных стволовых клеток являются лимфоидные или миелоидные стволовые клетки. [2] В частности, лимфоидная клетка может дать начало различным клеткам крови, таким как В- и Т-клетки, однако не другому типу клеток крови, такому как эритроцит. [42] Примерами клеток-предшественников являются сосудистые стволовые клетки, которые обладают способностью становиться как эндотелиальными , так и гладкомышечными клетками.
В клеточной биологии унипотентная клетка — это концепция, согласно которой одна стволовая клетка способна дифференцироваться только в один тип клеток. [43] В настоящее время неясно, существуют ли настоящие унипотентные стволовые клетки. Гепатобласты, которые дифференцируются в гепатоциты (составляющие большую часть печени ) или холангиоциты (эпителиальные клетки желчных протоков), являются бипотентными. [44] Близкий синоним унипотентной клетки — клетка-предшественник .