Трансцитоз (также известный как цитопепсис ) [1] — это тип трансцеллюлярного транспорта , при котором различные макромолекулы транспортируются через внутреннюю часть клетки . Макромолекулы захватываются в везикулы на одной стороне клетки, протягиваются через клетку и выбрасываются на другой стороне. Примерами транспортируемых макромолекул являются IgA , [2] трансферрин , [3] и инсулин . [4] Хотя трансцитоз чаще всего наблюдается в эпителиальных клетках , этот процесс также присутствует в других местах. Кровяные капилляры являются хорошо известным местом для трансцитоза, [5] хотя он происходит и в других клетках, включая нейроны , [6] остеокласты [7] и М-клетки кишечника . [8]
Регуляция трансцитоза сильно различается из-за множества различных тканей, в которых наблюдается этот процесс. Были выявлены различные тканеспецифичные механизмы трансцитоза. Было показано, что брефельдин А , широко используемый ингибитор транспорта ER -to- Golgi , ингибирует трансцитоз в клетках почек собак, что дало первые подсказки относительно природы регуляции трансцитоза. [9] Было также показано, что трансцитоз в клетках почек собак регулируется на апикальной мембране Rab17 , [10] а также Rab11a и Rab25 . [11] Дальнейшие исследования клеток почек собак показали, что сигнальный каскад , включающий фосфорилирование EGFR Yes , приводящее к активации Rab11FIP5 MAPK1 , усиливает трансцитоз. [12] Было показано, что трансцитоз ингибируется комбинацией прогестерона и эстрадиола с последующей активацией, опосредованной пролактином в молочной железе кролика во время беременности . [13] В щитовидной железе трансцитоз фолликулярных клеток регулируется положительно ТТГ [ требуется ссылка ] . Было показано, что фосфорилирование кавеолина 1, вызванное перекисью водорода, имеет решающее значение для активации трансцитоза в легочной сосудистой ткани . [14] Таким образом, можно сделать вывод, что регуляция трансцитоза является сложным процессом, который различается в разных тканях.
Благодаря функции трансцитоза как процесса, который транспортирует макромолекулы через клетки, он может быть удобным механизмом, с помощью которого патогены могут проникать в ткань. Было показано, что трансцитоз имеет решающее значение для проникновения Cronobacter sakazakii через эпителий кишечника, а также через гематоэнцефалический барьер . [15] Было показано, что Listeria monocytogenes проникает в просвет кишечника посредством трансцитоза через бокаловидные клетки . [16] Было показано, что токсин Шига, секретируемый энтерогеморрагической E. coli, трансцитируется в просвет кишечника. [17] Из этих примеров можно сказать, что трансцитоз имеет жизненно важное значение для процесса патогенеза различных инфекционных агентов.
Фармацевтические компании, такие как Lundbeck , в настоящее время изучают использование трансцитоза в качестве механизма транспортировки терапевтических препаратов через гематоэнцефалический барьер человека (ГЭБ). [ необходима цитата ] Использование собственного транспортного механизма организма может помочь преодолеть высокую селективность ГЭБ, который обычно блокирует поглощение большинства терапевтических антител в мозг и центральную нервную систему (ЦНС). Фармацевтическая компания Genentech , синтезировав терапевтическое антитело , которое эффективно ингибирует ферментативную функцию BACE1 , столкнулась с проблемами передачи адекватных, эффективных уровней антитела в мозг. BACE1 — это фермент, который перерабатывает белки-предшественники амилоида в пептиды амилоида-β , включая виды, которые агрегируют, образуя амилоидные бляшки, связанные с болезнью Альцгеймера . [ необходима цитата ]
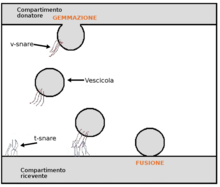
Молекулы транспортируются через эпителиальный или эндотелиальный барьер одним из двух путей: 1) трансцеллюлярный путь через внутриклеточный компартмент клетки или 2) парацеллюлярный путь через внеклеточное пространство между соседними клетками. [18] Трансцеллюлярный путь также называется трансцитозом. Трансцитоз может быть рецепторно-опосредованным и состоит из трех этапов: 1) рецепторно-опосредованный эндоцитоз молекулы на одной стороне клетки, например, люминальной стороне; 2) перемещение молекулы через внутриклеточный компартмент, как правило, в пределах эндосомальной системы; и 3) экзоцитоз молекулы во внеклеточное пространство на другой стороне клетки, например, аблюминальной стороне.
Трансцитоз может быть как однонаправленным, так и двунаправленным. Однонаправленный трансцитоз может происходить избирательно в люминально-аблюминальном направлении или в обратном направлении, в аблюминально-люминальном направлении.
Трансцитоз играет важную роль в микрососудистом транспорте пептидов и белков мозга [19], поскольку микрососудистый эндотелий мозга, который образует гематоэнцефалический барьер (ГЭБ) in vivo, экспрессирует уникальные, подобные эпителию, плотные контакты с высоким сопротивлением . [20] Плотные контакты эндотелия мозга фактически исключают парацеллюлярный путь транспорта растворенных веществ через микрососудистую эндотелиальную стенку в мозге. Напротив, эндотелиальный барьер в периферических органах не экспрессирует плотные контакты, и движение растворенных веществ через парацеллюлярный путь заметно в эндотелиальном барьере в органах, отличных от головного или спинного мозга. [21]
Рецепторно-опосредованный трансцитоз, или RMT, через ГЭБ является потенциальным путем доставки лекарств в мозг , особенно для биологических препаратов, таких как рекомбинантные белки. [22] Нетранспортабельное лекарство, или терапевтический белок, генетически слит с транспортным белком. Транспортный белок может быть эндогенным пептидом или пептидомиметическим моноклональным антителом, которое подвергается RMT через ГЭБ посредством транспорта на эндотелиальных рецепторах мозга, таких как инсулиновый рецептор или трансферриновый рецептор. Транспортный белок действует как молекулярный троянский конь, переправляя в мозг терапевтический белок, который генетически слит с троянским конем, специфичным для рецептора.
Моноклональные антитела-троянские кони, нацеленные на рецепторы инсулина или трансферрина ГЭБ, разрабатываются уже более 10 лет в компании ArmaGen, Inc., биотехнологической компании в Лос-Анджелесе. ArmaGen разработала генетически модифицированные антитела как против рецепторов инсулина, так и против рецепторов трансферрина и соединила с этими антителами различные терапевтические белки, включая лизосомальные ферменты, терапевтические антитела, рецепторы-приманки и нейротрофины. [23] Эти терапевтические белки сами по себе не пересекают ГЭБ, но после генетического слияния с антителом-троянским конем терапевтический белок проникает через ГЭБ со скоростью, сопоставимой с малыми молекулами. В 2015 году ArmaGen станет первой компанией, которая начнет клинические испытания на людях с белками слияния троянских коней ГЭБ, которые доставляют белковые препараты в мозг через путь трансцитоза. Человеческие заболевания, на которые изначально ориентировалась ArmaGen, — это лизосомальные болезни накопления, которые отрицательно влияют на мозг. Наследственные заболевания создают состояние, при котором не вырабатывается определенный лизосомальный фермент, что приводит к серьезным заболеваниям мозга, включая умственную отсталость, поведенческие проблемы и затем деменцию. Хотя недостающий фермент может быть произведен фармацевтическими компаниями, сам по себе ферментный препарат не лечит мозг, поскольку сам по себе фермент не пересекает ГЭБ. ArmaGen переделал недостающий лизосомальный фермент в белок слияния троянского коня и фермента, который пересекает ГЭБ. Первые клинические испытания новой технологии белка слияния троянского коня будут лечить мозг при лизосомных болезнях накопления, включая одно из заболеваний мукополисахаридоза I типа (MPSIH), также называемое синдромом Херлера , и МПС II типа, также называемое синдромом Хантера .
Исследователи из Genentech предложили создать биспецифическое антитело , которое могло бы связываться с мембраной ГЭБ, вызывать опосредованный рецептором трансцитоз и высвобождаться с другой стороны в мозг и ЦНС. Они использовали мышиное биспецифическое антитело с двумя активными участками, выполняющими разные функции. Одно плечо имело низкоаффинный сайт связывания анти- трансферринового рецептора , который вызывает трансцитоз. Высокоаффинный сайт связывания привел бы к тому, что антитело не смогло бы высвобождаться из мембраны ГЭБ после трансцитоза. Таким образом, количество транспортируемого антитела основывается на концентрации антитела по обе стороны барьера. Другое плечо имело ранее разработанный высокоаффинный сайт связывания анти-BACE1, который бы ингибировал функцию BACE1 и предотвращал образование амилоидных бляшек. Genentech удалось продемонстрировать на мышиных моделях, что новое биспецифическое антитело способно достигать терапевтических уровней в мозге. [24] Метод Genentech по маскировке и транспортировке терапевтического антитела путем присоединения его к активатору трансцитоза, опосредованному рецептором, получил название «метод троянского коня».