

Третичная структура нуклеиновой кислоты представляет собой трехмерную форму полимера нуклеиновой кислоты . [1] Молекулы РНК и ДНК способны выполнять разнообразные функции, от молекулярного распознавания до катализа . Такие функции требуют точной трехмерной структуры. Хотя такие структуры разнообразны и кажутся сложными, они состоят из повторяющихся, легко узнаваемых третичных структурных мотивов , которые служат молекулярными строительными блоками. Некоторые из наиболее распространенных мотивов третичной структуры РНК и ДНК описаны ниже, но эта информация основана на ограниченном количестве решенных структур. По мере структурной характеристики новых молекул РНК и ДНК будет выявлено еще больше третичных структурных мотивов.

Двойная спираль является доминирующей третичной структурой биологической ДНК, а также возможной структурой РНК. Считается, что в природе встречаются три конформации ДНК: A-ДНК , B-ДНК и Z-ДНК . Считается, что в клетках преобладает форма «B», описанная Джеймсом Д. Уотсоном и Фрэнсисом Криком . [2] Джеймс Д. Уотсон и Фрэнсис Крик описали эту структуру как двойную спираль с радиусом 10 Å и шагом 34 Å , совершающую один полный оборот вокруг своей оси каждые 10 пар оснований последовательности. [3] Двойная спираль делает один полный оборот вокруг своей оси каждые 10,4–10,5 пар оснований в растворе. Эта частота скручивания (известная как шаг спирали ) во многом зависит от сил укладки, которые каждое основание оказывает на своих соседей в цепи. Двойная спиральная РНК принимает конформацию, аналогичную структуре А-формы.
Возможны и другие конформации; Фактически, теперь для описания любой новой структуры ДНК, которая может появиться в будущем, доступны только буквы F, Q, U, V и Y. [4] [5] Однако большинство этих форм были созданы синтетически и не наблюдались в естественных биологических системах.
Триплекс малой бороздки представляет собой повсеместный структурный мотив РНК . Поскольку взаимодействие с малой бороздкой часто опосредуется 2'-ОН сахара рибозы , этот мотив РНК сильно отличается от своего ДНК- эквивалента. Наиболее распространенным примером тройки малой бороздки является мотив A-минор или вставка аденозиновых оснований в малую бороздку (см. Выше). Однако этот мотив не ограничивается аденозинами, поскольку также наблюдалось взаимодействие других нуклеиновых оснований с малой бороздкой РНК.
Малая канавка представляет собой почти идеальное дополнение для вставленного основания. Это обеспечивает оптимальные контакты Ван-дер-Ваальса , обширные водородные связи и гидрофобную поверхность, а также создает очень энергетически выгодное взаимодействие. [8] [9] Поскольку тройки малых бороздок способны стабильно упаковывать свободную петлю и спираль, они являются ключевыми элементами в структуре больших рибонуклеотидов , включая интрон группы I, [10] интрон группы II, [11] и рибосома . _
Хотя большая бороздка стандартной А-формы РНК довольно узкая и, следовательно, менее доступна для триплексного взаимодействия, чем малая бороздка, триплексные взаимодействия с большой бороздкой можно наблюдать в некоторых структурах РНК. Эти структуры состоят из нескольких комбинаций пар оснований и взаимодействий Хугстина. Например, триплекс GGC (GGC амино(N-2)-N-7, имино-карбонил, карбонил-амино(N-4); Уотсон-Крик), наблюдаемый в 50S рибосоме , состоит из GC типа Уотсона-Крика. пара и входящий G, который образует псевдо-Хогстинову сеть взаимодействий водородных связей между обоими основаниями, участвующими в каноническом спаривании. [12] Другие примечательные примеры триплексов с большой бороздкой включают (i) каталитическое ядро интрона группы II, показанное на рисунке слева [6] (ii) каталитически важную тройную спираль , наблюдаемую в теломеразной РНК человека [7] (iii) рибопереключатель SAM -II [14] и (iv) элемент ядерной экспрессии (ENE), который действует как элемент стабилизации РНК посредством образования тройной спирали с поли(А)-хвостом. [15] [16]
Трехцепочечная ДНК также возможна из-за связей Хугстина или обратных водородных связей Хугстина в основной бороздке B-формы ДНК .
Помимо двойных спиралей и вышеупомянутых триплексов, РНК и ДНК могут также образовывать четверные спирали. Существуют разнообразные структуры квадруплексов оснований РНК. Четыре последовательных остатка гуанина могут образовывать квадруплекс в РНК за счет водородных связей Хугстина , образуя «кольцо Хугстина» (см. рисунок). [12] Пары GC и AU также могут образовывать базовый квадруплекс с комбинацией спаривания Уотсона-Крика и неканонического спаривания в малой бороздке . [17]
Ядро аптамера малахитового зеленого также представляет собой разновидность базового квадруплекса с другим паттерном водородных связей (см. Рисунок). [13] Квадруплекс может повторяться несколько раз подряд, создавая чрезвычайно стабильную структуру.
Уникальная структура квадруплексных участков РНК может выполнять различные функции в биологической системе. Двумя важными функциями являются потенциал связывания с лигандами или белками и его способность стабилизировать всю третичную структуру ДНК или РНК. Сильная структура может ингибировать или модулировать транскрипцию и репликацию , например, в теломерах хромосом и UTR мРНК. [18] Идентичность оснований важна для связывания лиганда. G-квартет обычно связывает одновалентные катионы, такие как калий, в то время как другие основания могут связывать множество других лигандов, таких как гипоксантин, в квадруплексе UUCU. [17]
Наряду с этими функциями G-квадруплекс в мРНК вокруг областей связывания рибосом может служить регулятором экспрессии генов у бактерий . [19] Возможно, существуют еще более интересные структуры и функции, которые еще предстоит открыть in vivo .

Коаксиальная укладка, также известная как спиральная укладка, является основным фактором, определяющим третичную структуру РНК более высокого порядка. Коаксиальная укладка происходит, когда два дуплекса РНК образуют непрерывную спираль, которая стабилизируется за счет укладки оснований на границе раздела двух спиралей. В кристаллической структуре тРНКФе отмечена коаксиальная укладка . [21] Совсем недавно коаксиальная укладка наблюдалась в структурах более высокого порядка многих рибозимов , включая многие формы самосплайсинговых интронов группы I и группы II . Распространенные мотивы коаксиальной укладки включают взаимодействие целующейся петли и псевдоузла . Устойчивость этих взаимодействий можно предсказать путем адаптации «правил Тернера». [22]
В 1994 году Уолтер и Тернер определили вклады свободной энергии стекинг-взаимодействий ближайших соседей внутри интерфейса спираль-спираль, используя модельную систему, которая создавала интерфейс спираль-спираль между коротким олигомером и выступающим элементом из четырех нуклеотидов на конце шпильки . корень . Их эксперименты подтвердили, что термодинамический вклад укладки оснований между двумя спиральными вторичными структурами близко имитирует термодинамику образования стандартного дуплекса (взаимодействия ближайших соседей предсказывают термодинамическую стабильность образующейся спирали). Относительная стабильность взаимодействий ближайших соседей может быть использована для прогнозирования благоприятной коаксиальной упаковки на основе известной вторичной структуры. Уолтер и Тернер обнаружили, что в среднем точность предсказания структуры РНК улучшилась с 67% до 74%, когда были включены вклады коаксиального укладки. [23]
Большинство хорошо изученных третичных структур РНК содержат примеры коаксиальной укладки. Некоторыми яркими примерами являются тРНК-Phe, интроны группы I, интроны группы II и рибосомальные РНК. Кристаллические структуры тРНК выявили наличие двух удлиненных спиралей, возникающих в результате коаксиальной укладки акцепторного стебля аминокислот с Т-плечом, а также укладки D- и антикодонов. Эти взаимодействия внутри тРНК ориентируют стебель антикодона перпендикулярно стеблю аминокислот, что приводит к функциональной L-образной третичной структуре. [21] В интронах группы I было показано, что спирали P4 и P6 коаксиально укладываются с помощью комбинации биохимических [24] и кристаллографических методов. Кристаллическая структура P456 дала подробное представление о том, как коаксиальная укладка стабилизирует упаковку спиралей РНК в третичные структуры. [25] В интроне группы самосплайсинга II Oceanobacillus iheyensis стебли IA и IB коаксиально штабелируются и способствуют относительной ориентации составляющих спиралей пятистороннего соединения. [6] Такая ориентация способствует правильному сворачиванию активного сайта функционального рибозима. Рибосома содержит многочисленные примеры коаксиальной укладки, включая сложенные сегменты длиной до 70 п.н. [26]

Двумя распространенными мотивами, включающими коаксиальную укладку, являются петли поцелуев и псевдоузлы. При взаимодействии целующихся петель одноцепочечные области петель двух шпилек взаимодействуют посредством спаривания оснований, образуя сложную, коаксиально уложенную спираль. Примечательно, что эта структура позволяет всем нуклеотидам в каждой петле участвовать во взаимодействиях спаривания оснований и штабелирования. Этот мотив был визуализирован и изучен с помощью ЯМР-анализа Ли и Кротерсом. [27] Мотив псевдоузла возникает, когда одноцепочечная область петли шпильки спаривается с последовательностью выше или ниже в пределах одной и той же цепи РНК. Две образующиеся дуплексные области часто накладываются друг на друга, образуя стабильную коаксиально сложенную составную спираль. Одним из примеров мотива псевдоузла является высокостабильный рибозим вируса гепатита Дельта, основная цепь которого демонстрирует общую топологию двойного псевдоузла. [28]
Эффект, подобный коаксиальному стэкингу, наблюдался в рационально спроектированных структурах ДНК. Структуры ДНК-оригами содержат большое количество двойных спиралей с открытыми тупыми концами. Было замечено, что эти структуры слипаются по краям, содержащим эти открытые тупые концы, из-за гидрофобных взаимодействий при штабелировании. [29]

Взаимодействия тетрапетля-рецептор сочетают в себе взаимодействия спаривания оснований и укладки между нуклеотидами петли мотива тетрапетли и мотива рецептора, расположенного внутри дуплекса РНК, создавая третичный контакт, который стабилизирует глобальную третичную укладку молекулы РНК . Тетрапетли также являются возможными структурами в дуплексах ДНК. [31]
Стеблевые петли могут сильно различаться по размеру и последовательности, но тетрапетли из четырех нуклеотидов очень распространены и обычно относятся к одной из трех категорий в зависимости от последовательности. [32] Эти три семейства представляют собой тетралупы CUYG, UNCG и GNRA (см. рисунок справа) . [33] В каждом из этих семейств тетрапетли второй и третий нуклеотиды образуют поворот в цепи РНК, а пара оснований между первым и четвертым нуклеотидами стабилизирует структуру стебельковой петли. В целом установлено, что стабильность тетрапетли зависит от состава оснований внутри петли и от состава этой «замыкающей пары оснований». [34] Семейство тетрапетлей GNRA чаще всего наблюдается во взаимодействиях тетрапетля-рецептор. Кроме того, известно, что тетрапетли UMAC являются альтернативными версиями петель GNRA, обе имеют схожие структуры основной цепи; несмотря на сходство, они различаются возможными дальнодействующими взаимодействиями, на которые способны. [35]

«Рецепторные мотивы тетрапетли» представляют собой третичные взаимодействия дальнего действия [36] , состоящие из водородных связей между основаниями тетрапетли и последовательностями стебельковой петли в дистальных участках вторичной структуры РНК. [37] Помимо водородных связей, важным компонентом этих третичных взаимодействий являются стэкинг-взаимодействия. Например, во взаимодействиях GNRA-тетрапетля второй нуклеотид тетрапетли укладывается непосредственно на мотив A-платформы (см. Выше) внутри рецептора. [25] Последовательность тетрапетли и ее рецептора часто коварна, так что один и тот же тип третичного контакта может быть установлен с разными изоформами тетрапетли и родственного ей рецептора. [38]
Например, структура и функция самосплайсируемого интрона группы I зависят от мотивов тетрапетлевого рецептора. [25] [37] В частности, три адениновых остатка канонического мотива GAAA укладываются на вершину спирали рецептора и образуют множественные стабилизирующие водородные связи с рецептором. Первый аденин последовательности GAAA образует тройную пару оснований с основаниями AU рецептора. Второй аденин стабилизируется за счет водородных связей с тем же уридином, а также через его 2'-ОН с рецептором и за счет взаимодействий с гуанином тетрапетли GAAA. Третий аденин образует тройную пару оснований.
А-минорный мотив представляет собой повсеместно встречающийся третичный структурный мотив РНК. Он образуется путем вставки неспаренного нуклеозида в малую бороздку дуплекса РНК. По существу, это пример тройки второстепенных канавок. Хотя гуанозин, цитозин и уридин также могут образовывать тройные взаимодействия малых бороздок, взаимодействия малых бороздок с аденином очень распространены. В случае аденина край N1-C2-N3 внедряющего основания образует водородные связи с одним или обоими 2'-ОН дуплекса, а также с основаниями дуплекса (см. рисунок: A-минорные взаимодействия ). Дуплекс хоста часто представляет собой базовую пару GC.
А-минорные мотивы были разделены на четыре класса, [8] [9] типы от 0 до III, в зависимости от положения вставляющего основания относительно двух 2'-ОН пары оснований Уотсона- Крика . В A-минорных мотивах I и II типа N3 аденина вставлен глубоко в малую бороздку дуплекса (см. Рисунок: Взаимодействия A-минор - взаимодействие типа II), и имеется хорошая комплементарность формы с парой оснований. В отличие от типов 0 и III, взаимодействия типа I и II специфичны для аденина за счет взаимодействий по водородным связям. При взаимодействии типа III как O2', так и N3 вставляющего основания менее тесно связаны с малой бороздкой дуплекса. Мотивы типов 0 и III более слабы и неспецифичны, поскольку они опосредованы взаимодействиями с одним 2'-ОН (см. Рисунок: А-минорные взаимодействия - взаимодействия типа 0 и типа III).
А-минорный мотив является одним из наиболее распространенных структурных мотивов РНК в рибосоме, где он способствует связыванию тРНК с субъединицей 23S. [40] Чаще всего они стабилизируют дуплексные взаимодействия РНК в петлях и спиралях, например, в ядре интронов группы II. [6]
Интересным примером А-минора является его роль в распознавании антикодонов . Рибосома должна различать правильные и неправильные пары кодон-антикодон. Частично это происходит за счет внедрения адениновых оснований в малую бороздку. Неправильные пары кодон-антикодон будут иметь искаженную спиральную геометрию, что не позволит А-минорному взаимодействию стабилизировать связывание и увеличит скорость диссоциации неправильной тРНК. [41]
Анализ A-минорных мотивов в 23S рибосомальной РНК выявил иерархическую сеть структурных зависимостей, которые, как предполагается, связаны с эволюцией рибосом и порядком событий, которые привели к развитию современной бактериальной большой субъединицы. [42]
Сообщается, что A-минорный мотив и его новый подкласс, A-минорные взаимодействия WC/H, укрепляют другие третичные структуры РНК, такие как тройные спирали с большой бороздкой, идентифицированные в элементах стабилизации РНК. [16] [15]
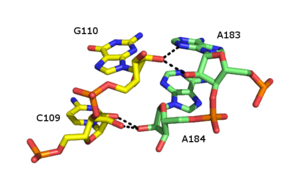
Рибозная молния представляет собой третичный структурный элемент РНК , в котором две цепи РНК удерживаются вместе за счет взаимодействий водородных связей с участием 2'OH сахаров рибозы на разных цепях. 2'OH может вести себя как донор и акцептор водородной связи, что позволяет образовывать раздвоенные водородные связи с другим 2'OH. [43] [44]
Сообщалось о многочисленных формах рибозной застежки, но общий тип включает четыре водородные связи между 2'-ОН-группами двух соседних сахаров. Рибозные молнии обычно встречаются в виде массивов, которые стабилизируют взаимодействия между отдельными цепями РНК. [45] Рибозные молнии часто наблюдаются как взаимодействия «стебель-петля» с очень низкой специфичностью последовательности. Однако в малых и больших субъединицах рибосом существует склонность к образованию рибозных застежек последовательности CC/AA: два цитозина в первой цепи соединены с двумя аденинами во второй цепи.
Функциональные РНК часто представляют собой свернутые стабильные молекулы трехмерной формы, а не гибкие линейные нити. [47] Катионы необходимы для термодинамической стабилизации третичных структур РНК. Катионы металлов, связывающие РНК, могут быть одновалентными, двухвалентными и трехвалентными. Калий (К + ) — обычный одновалентный ион, связывающий РНК. Обычным двухвалентным ионом, который связывает РНК, является магний (Mg 2+ ). Было обнаружено, что другие ионы, включая натрий (Na + ), кальций (Ca2 + ) и марганец (Mn2 + ), связывают РНК in vivo и in vitro . Многовалентные органические катионы, такие как спермидин или спермин , также обнаруживаются в клетках и вносят важный вклад в сворачивание РНК. Трехвалентные ионы, такие как гексамин кобальта, или ионы лантаноидов, такие как тербий (Tb 3+ ), являются полезными экспериментальными инструментами для изучения связывания металлов с РНК. [48] [49]
Ион металла может взаимодействовать с РНК несколькими способами. Ион может диффузно ассоциироваться с основной цепью РНК, экранируя в противном случае неблагоприятные электростатические взаимодействия . Такое экранирование заряда часто осуществляется одновалентными ионами. Ионы, связанные с сайтом, стабилизируют определенные элементы третичной структуры РНК. Взаимодействия, связанные с сайтом, можно разделить на две категории в зависимости от того, опосредует ли вода связывание металла. Взаимодействия «внешней сферы» опосредуются молекулами воды, окружающими ион металла. Например, гексагидрат магния взаимодействует и стабилизирует определенные мотивы третичной структуры РНК посредством взаимодействия с гуанозином в большой бороздке. И наоборот, взаимодействия «внутренней сферы» напрямую опосредуются ионом металла. РНК часто сворачивается в несколько этапов, и эти этапы можно стабилизировать различными типами катионов. На ранних стадиях РНК образует вторичные структуры, стабилизированные за счет связывания одновалентных катионов, двухвалентных катионов и полианионных аминов с целью нейтрализации полианионной основной цепи. Более поздние стадии этого процесса включают формирование третичной структуры РНК, которая стабилизируется в основном за счет связывания двухвалентных ионов, таких как магний, с возможным вкладом связывания калия.
Сайты связывания металлов часто локализуются в глубокой и узкой большой бороздке дуплекса РНК, координируясь с хугстиновыми краями пуринов . В частности, катионы металлов стабилизируют места скручивания основной цепи, где плотная упаковка фосфатов приводит к образованию области плотного отрицательного заряда. В дуплексах РНК имеется несколько мотивов, связывающих ионы металлов, которые были идентифицированы в кристаллических структурах. Например, в домене P4-P6 интрона группы I Tetrahymena thermophila несколько сайтов связывания ионов состоят из тандемных пар колебаний GU и тандемных несоответствий GA , в которых двухвалентные катионы взаимодействуют с гуанозиновым краем Хугстина через O6 и N7. [50] [51] [52] Еще одним ион-связывающим мотивом в интроне группы I тетрахимены является мотив платформы AA, в котором последовательные аденозины в одной и той же цепи РНК образуют неканоническую пару псевдооснований. [53] В отличие от тандемного мотива GU, мотив платформы AA связывается преимущественно с одновалентными катионами. Во многих из этих мотивов отсутствие одновалентных или двухвалентных катионов приводит либо к большей гибкости, либо к потере третичной структуры.
Было обнаружено, что ионы двухвалентных металлов, особенно магния , важны для структуры соединений ДНК, таких как промежуточное соединение Холлидея в генетической рекомбинации . Ион магния экранирует отрицательно заряженные фосфатные группы в соединении и позволяет им располагаться ближе друг к другу, создавая сложную конформацию, а не несложенную конформацию. [54] Магний жизненно важен для стабилизации такого рода соединений в искусственно созданных структурах, используемых в нанотехнологиях ДНК , таких как мотив двойного кроссовера. [55]
Самые ранние работы в области структурной биологии РНК более или менее совпадали с работами по ДНК, проводившимися в начале 1950-х годов. В своей основополагающей статье 1953 года Уотсон и Крик предположили, что скученность Ван-дер-Ваальса 2`ОН-группой рибозы не позволит РНК принять двойную спиральную структуру, идентичную предложенной ими модели – то, что мы теперь знаем как ДНК B-формы. [56] Это вызвало вопросы о трехмерной структуре РНК: может ли эта молекула образовывать спиральную структуру того или иного типа, и если да, то как?
В середине 1960-х годов интенсивно изучалась роль тРНК в синтезе белка. В 1965 году Холли и др. очистили и секвенировали первую молекулу тРНК, первоначально предположив, что она приняла структуру клеверного листа, основанную в основном на способности определенных областей молекулы образовывать структуры стебельковой петли. [57] Выделение тРНК оказалось первой крупной находкой в структурной биологии РНК. В 1971 году Ким и др. добились еще одного прорыва, создав кристаллы дрожжевой тРНК PHE , которые дифрагировали до разрешения 2-3 ангстрема с использованием спермина, природного полиамина , который связывался и стабилизировал тРНК. [58]
В течение значительного времени после появления первых структур тРНК область структуры РНК существенно не продвинулась вперед. Возможность изучения структуры РНК зависела от возможности выделить РНК-мишень. На протяжении многих лет это ограничивало область применения, отчасти потому, что другие известные мишени, например, рибосому , было значительно сложнее изолировать и кристаллизовать. Таким образом, в течение примерно двадцати лет после первоначальной публикации структуры тРНК PHE были решены структуры лишь нескольких других мишеней РНК, причем почти все из них принадлежали к семейству транспортных РНК. [59]
Это досадное отсутствие возможностей в конечном итоге будет преодолено во многом благодаря двум крупным достижениям в исследованиях нуклеиновых кислот: идентификации рибозимов и способности производить их посредством транскрипции in vitro . После публикации Тома Чеха о том, что интрон группы I тетрахимены является автокаталитическим рибозимом [60] и отчета Сидни Альтмана о катализе рибонуклеазой P РНК [61] в конце 1980-х годов было идентифицировано несколько других каталитических РНК, [62] в том числе «головка молотка ». рибозим. В 1994 году Маккей и др. опубликовали структуру «молотообразного комплекса РНК-ДНК-рибозим-ингибитор» с разрешением 2,6 ангстрема, в котором автокаталитическая активность рибозима нарушалась за счет связывания с ДНК-субстратом. [63] В дополнение к достижениям в определении глобальной структуры с помощью кристаллографии, в начале 1990-х годов также наблюдалось применение ЯМР как мощного метода в структурной биологии РНК. Подобные исследования позволили более точно охарактеризовать взаимодействия спаривания и укладки оснований, которые стабилизировали глобальные складки больших молекул РНК.
Возрождение структурной биологии РНК в середине 1990-х годов вызвало настоящий взрыв в области структурных исследований нуклеиновых кислот. С момента публикации структур «головка-молот» и P 4-6 в эту область было внесено множество крупных вкладов. Некоторые из наиболее примечательных примеров включают структуры интронов группы I и группы II [6] и рибосомы . [39] Первые три структуры были получены с использованием транскрипции in vitro , и тот факт, что ЯМР сыграл роль в исследовании частичных компонентов всех четырех структур, свидетельствует о незаменимости обоих методов для исследования РНК. Нобелевская премия по химии 2009 года была присуждена Аде Йонат , Венкатраману Рамакришнану и Томасу Стейтцу за их структурные работы над рибосомой , продемонстрировавшие выдающуюся роль, которую структурная биология РНК сыграла в современной молекулярной биологии.
{{cite journal}}: CS1 maint: multiple names: authors list (link)