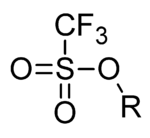

В органической химии трифлат ( систематическое название : трифторметансульфонат ) — это функциональная группа с формулой R−OSO 2 CF 3 и структурой R−O−S(=O) 2 −CF 3 . Трифлатная группа часто обозначается как −OTf , в отличие от −Tf, которая является трифлильной группой , R−SO 2 CF 3 . Например, н - бутилтрифлат можно записать как CH 3 CH 2 CH 2 CH 2 OTf .
Соответствующий трифлат- анион , CF 3 SO−3, является чрезвычайно стабильным многоатомным ионом ; это происходит из-за того, что трифторметансульфоновая кислота ( CF 3 SO 3 H ) является суперкислотой ; то есть она более кислая, чем чистая серная кислота , которая уже является одной из самых сильных известных кислот .
Трифлатная группа является превосходной уходящей группой , используемой в некоторых органических реакциях , таких как нуклеофильное замещение , реакции Сузуки и реакции Хека . Поскольку алкилтрифлаты чрезвычайно реакционноспособны в реакциях S N 2 , их следует хранить в условиях, свободных от нуклеофилов (таких как вода ). Анион обязан своей стабильностью резонансной стабилизации , которая заставляет отрицательный заряд симметрично распределяться по трем атомам кислорода. Дополнительная стабилизация достигается трифторметильной группой, которая действует как сильная электроноакцепторная группа, используя атом серы в качестве мостика.
Трифлаты также применялись в качестве лигандов для металлов 11 и 13 групп наряду с лантаноидами .
Трифлаты лития используются в некоторых литий-ионных аккумуляторах в качестве компонента электролита .
Мягким трифлатирующим реагентом является фенилтрифлимид или N , N -бис(трифторметансульфонил)анилин , где побочным продуктом является [ CF3SO2N − Ph ] − .
Трифлатные соли термически очень стабильны с температурой плавления до 350 °C для солей натрия , бора и серебра , особенно в безводной форме. Их можно получить непосредственно из трифторметансульфоновой кислоты и гидроксида металла или карбоната металла в воде. Альтернативно, их можно получить путем реакции хлоридов металлов с чистой трифторметансульфоновой кислотой или трифторметансульфоновой кислотой серебра или путем реакции трифторметансульфоновой кислоты бария с сульфатами металлов в воде: [1]
Трифлаты металлов используются в качестве катализаторов кислот Льюиса в органической химии . Особенно полезны трифлаты лантаноидов типа Ln(OTf) 3 (где Ln — лантаноид ) . Родственный популярный катализатор трифлат скандия используется в таких реакциях, как альдольные реакции и реакции Дильса-Альдера . Примером является реакция альдольного присоединения Мукаямы между бензальдегидом и силиловым енольным эфиром циклогексанона с химическим выходом 81% . [2] Соответствующая реакция с солью иттрия не проходит:

Трифлат — широко используемый слабокоординирующий анион .
