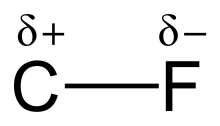
Связь углерод–фтор — это полярная ковалентная связь между углеродом и фтором , которая является компонентом всех фторорганических соединений . Это одна из самых сильных одинарных связей в химии (после одинарной связи B–F , одинарной связи Si–F и одинарной связи H–F) и относительно короткая из-за ее частично ионного характера. Связь также укрепляется и укорачивается по мере добавления большего количества фторов к одному и тому же атому углерода в химическом соединении . Таким образом, фторалканы , такие как тетрафторметан (тетрафторид углерода), являются одними из самых нереакционноспособных органических соединений.
Высокая электроотрицательность фтора (4,0 для фтора против 2,5 для углерода) придает связи углерод–фтор значительную полярность или дипольный момент . Электронная плотность сосредоточена вокруг фтора, оставляя углерод относительно бедным электронами. Это придает связи ионный характер через частичные заряды (C δ+ —F δ− ). Частичные заряды на фторе и углероде притягиваются, способствуя необычной прочности связи углерод–фтор. Связь обозначена как «самая прочная в органической химии» [1] , потому что фтор образует самую прочную одинарную связь с углеродом. Связи углерод–фтор могут иметь энергию диссоциации связи (BDE) до 130 ккал/моль. [2] BDE (прочность связи) C–F выше, чем у других связей углерод– галоген и углерод– водород . Например, BDE связи C–X в молекуле CH 3 –X составляют 115, 104,9, 83,7, 72,1 и 57,6 ккал/моль для X = фтор, водород , хлор , бром и йод соответственно. [3]
Длина связи углерод-фтор обычно составляет около 1,35 ангстрема (1,39 Å во фторметане ). [1] Она короче, чем любая другая связь углерод-галоген, и короче, чем одинарные связи углерод- азот и углерод- кислород . Короткая длина связи также может быть связана с ионным характером связи (электростатическим притяжением между частичными зарядами на углероде и фторе). Длина связи углерод-фтор варьируется на несколько сотых ангстрема в зависимости от гибридизации атома углерода и наличия других заместителей на углероде или даже в атомах, расположенных дальше. Эти колебания можно использовать в качестве указания на тонкие изменения гибридизации и стереоэлектронные взаимодействия . В таблице ниже показано, как средняя длина связи изменяется в различных связевых средах (атомы углерода sp 3 -гибридизованы, если иное не указано для sp 2 или ароматического углерода).
Изменчивость длин связей и укорочение связей с фтором из-за их частичного ионного характера также наблюдаются для связей между фтором и другими элементами и были источником трудностей с выбором подходящего значения для ковалентного радиуса фтора . Лайнус Полинг первоначально предложил 64 пм , но это значение в конечном итоге было заменено на 72 пм, что составляет половину длины связи фтор-фтор. Однако 72 пм слишком долго, чтобы быть репрезентативным для длин связей между фтором и другими элементами, поэтому другие авторы предложили значения между 54 пм и 60 пм. [5] [6] [7] [8]
С увеличением числа атомов фтора на одном и том же ( геминальном ) углероде другие связи становятся прочнее и короче. Это можно увидеть по изменениям длины и прочности связи (BDE) для ряда фторметана, как показано в таблице ниже; также частичные заряды ( q C и q F ) на атомах изменяются внутри ряда. [2] Частичный заряд на углероде становится более положительным по мере добавления фтора, увеличивая электростатические взаимодействия и ионный характер между фтором и углеродом.

Когда два атома фтора находятся в вицинальных (т.е. соседних) атомах углерода, как в 1,2-дифторэтане (H 2 FCCFH 2 ), гош -конформер более стабилен, чем анти-конформер — это противоположно тому, что обычно ожидается, и тому, что наблюдается для большинства 1,2-дизамещенных этанов; это явление известно как гош-эффект . [9] В 1,2-дифторэтане гош-конформация более стабильна, чем анти-конформация, на 2,4–3,4 кДж/моль в газовой фазе. Однако этот эффект не является уникальным для галогена фтора; гош-эффект наблюдается также для 1,2-диметоксиэтана . Связанный эффект — цис-эффект алкена . Например, цис-изомер 1,2-дифторэтилена более стабилен, чем транс-изомер. [10]
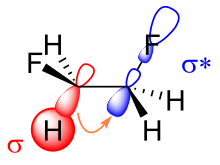
Существует два основных объяснения гош-эффекта: гиперконъюгация и изогнутые связи . В модели гиперконъюгации передача электронной плотности от связывающей σ-орбитали углерода-водорода к антисвязывающей σ * -орбитали углерода-фтора считается источником стабилизации в гош-изомере. Из-за большей электроотрицательности фтора σ-орбиталь углерода-водорода является лучшим донором электронов, чем σ-орбиталь углерода-фтора, в то время как σ * -орбиталь углерода-фтора является лучшим акцептором электронов, чем σ * -орбиталь углерода-водорода. Только гош-конформация допускает хорошее перекрытие между лучшим донором и лучшим акцептором. [11]
Ключевым моментом в объяснении эффекта гоша в дифторэтане с помощью изогнутой связи является повышенный характер p-орбитали обеих связей углерод-фтор из-за большой электроотрицательности фтора. В результате электронная плотность нарастает выше и ниже слева и справа от центральной связи углерод-углерод. Результирующее уменьшенное перекрытие орбиталей может быть частично компенсировано, когда предполагается конформация гоша, образуя изогнутую связь. Из этих двух моделей гиперконъюгация обычно считается основной причиной эффекта гоша в дифторэтане. [1] [12]
Растяжение связи углерод-фтор проявляется в инфракрасном спектре между 1000 и 1360 см −1 . Широкий диапазон обусловлен чувствительностью частоты растяжения к другим заместителям в молекуле. Монофторированные соединения имеют сильную полосу между 1000 и 1110 см −1 ; при наличии более одного атома фтора полоса расщепляется на две полосы, одну для симметричного режима и одну для асимметричного. [13] Полосы углерод-фтор настолько сильны, что они могут скрывать любые полосы углерод-водород, которые могут присутствовать. [14]
Фторорганические соединения также можно охарактеризовать с помощью ЯМР-спектроскопии , используя углерод-13 , фтор-19 (единственный природный изотоп фтора) или водород-1 (если присутствует). Химические сдвиги в 19 F ЯМР проявляются в очень широком диапазоне, в зависимости от степени замещения и функциональной группы. В таблице ниже показаны диапазоны для некоторых основных классов. [15]
Разрыв связей C–F представляет интерес как способ разложения и уничтожения фторорганических « вечных химикатов », таких как PFOA и перфторированные соединения (PFC). Возможные методы включают катализаторы, такие как атомы платины; [16] фотокатализаторы; УФ, иодид и сульфит, [17] радикалы; и т. д.
Некоторые комплексы металлов расщепляют связи CF. Эти реакции представляют интерес с точки зрения органического синтеза и ремедиации ксенохимикатов. [18] Активация связи CF классифицируется следующим образом: "(i) окислительное присоединение фторуглерода, (ii) образование связи M–C с элиминированием HF, (iii) образование связи M–C с элиминированием фторсилана, (iv) гидродефторирование фторуглерода с образованием связи M–F, (v) нуклеофильная атака на фторуглерод и (vi) дефторирование фторуглерода". Иллюстративная реакция активации CF, опосредованная металлом, - это дефторирование фторгексана дигидридом цирконоцена :