В термодинамике удельная теплоемкость (символ c ) вещества — это теплоемкость образца вещества, деленная на массу образца, также иногда называемая массовой теплоемкостью или удельной теплоемкостью. [1] Неофициально это количество тепла , которое необходимо добавить к одной единице массы вещества, чтобы вызвать повышение температуры на одну единицу . Единица удельной теплоемкости в системе СИ — джоуль на кельвин на килограмм , Дж⋅кг −1 ⋅К −1 . [2] Например, количество тепла, необходимое для повышения температуры1 кг воды по1 К это4184 джоуля , значит, удельная теплоемкость воды равна4184 Дж⋅кг −1 ⋅К −1 . [3]
Удельная теплоемкость часто меняется в зависимости от температуры и различна для каждого состояния вещества . Жидкая вода имеет одну из самых высоких удельных теплоемкостей среди обычных веществ, около4184 Дж⋅кг -1 ⋅К -1 при 20 °С; но лед, температура которого чуть ниже 0 °C, всего лишь2093 Дж⋅кг −1 ⋅К −1 . Удельные теплоемкости железа , гранита и газообразного водорода составляют около 449 Дж⋅кг -1 ⋅К -1 , 790 Дж⋅кг -1 ⋅К -1 и 14300 Дж⋅кг -1 ⋅К -1 соответственно. [4] Пока вещество претерпевает фазовый переход , например плавление или кипение, его удельная теплоемкость технически не определена, поскольку тепло идет на изменение его состояния, а не на повышение температуры.
Удельная теплоемкость вещества, особенно газа, может быть значительно выше, когда ему позволяют расширяться при нагревании (удельная теплоемкость при постоянном давлении ), чем когда его нагревают в закрытом сосуде, препятствующем расширению (удельная теплоемкость при постоянном объеме ). Эти два значения обычно обозначаются символами и соответственно; их частное является коэффициентом теплоемкости .
Термин «удельная теплоемкость» может также относиться к соотношению удельных теплоемкостей вещества при данной температуре и эталонного вещества при эталонной температуре, например воды при 15 °C; [5] во многом похоже на удельный вес . Удельная теплоемкость связана также с другими интенсивными мерами теплоемкости с другими знаменателями. Если количество вещества измеряется в количестве молей , вместо этого получают молярную теплоемкость , единицей которой в системе СИ является джоуль на кельвин на моль, Дж⋅моль −1 ⋅K −1 . Если за количество принять объем образца (как это иногда делается в технике), можно получить объемную теплоемкость , единицей которой в системе СИ является джоуль на кельвин на кубический метр , Дж⋅м −3 ⋅K −1 .
Одним из первых учёных, применивших эту концепцию, был Джозеф Блэк , врач XVIII века и профессор медицины в Университете Глазго . Он измерил удельную теплоемкость многих веществ, используя термин теплоемкость . [6]
Удельная теплоемкость вещества, обычно обозначаемая или , представляет собой теплоемкость образца вещества, деленную на массу образца: [7]
Как и теплоемкость объекта, удельная теплоемкость вещества может изменяться, иногда существенно, в зависимости от начальной температуры образца и приложенного к нему давления . Следовательно, его следует рассматривать как функцию этих двух переменных.
Эти параметры обычно указывают при указании удельной теплоемкости вещества. Например, «Вода (жидкость): = 4187 Дж⋅кг −1 ⋅K −1 (15 °C)». [8] Если не указано иное, опубликованные значения удельной теплоемкости обычно действительны для некоторых стандартных условий температуры и давления .
Однако зависимость от начальной температуры и давления часто можно игнорировать в практическом контексте, например, при работе в узких диапазонах этих переменных. В таких случаях обычно опускают квалификатор и аппроксимируют удельную теплоемкость константой, подходящей для этих диапазонов.
Удельная теплоемкость — это интенсивное свойство вещества, внутренняя характеристика, не зависящая от размера или формы рассматриваемого количества. (Определитель «специфический» перед экстенсивным свойством часто указывает на производное от него интенсивное свойство. [9] ) .
Введение тепловой энергии в вещество, помимо повышения его температуры, обычно вызывает увеличение его объема и/или давления, в зависимости от того, как удерживается образец. Выбор последнего влияет на измеряемую удельную теплоемкость даже при одинаковых пусковом давлении и начальной температуре . Широко используются два конкретных варианта:
Значение обычно меньше значения . Эта разница особенно заметна для газов, где значения при постоянном давлении обычно на 30–66,7% выше, чем при постоянном объеме. Следовательно, коэффициент теплоемкости газов обычно составляет от 1,3 до 1,67. [10]
Удельную теплоемкость можно определить и измерить для газов, жидкостей и твердых тел довольно общего состава и молекулярной структуры. К ним относятся газовые смеси, растворы и сплавы или гетерогенные материалы, такие как молоко, песок, гранит и бетон, если рассматривать их в достаточно большом масштабе.
Удельную теплоемкость можно определить также для материалов, состояние или состав которых меняется при изменении температуры и давления, при условии, что эти изменения обратимы и постепенны. Так, например, понятия определимы для газа или жидкости, диссоциирующих при повышении температуры, пока продукты диссоциации быстро и полностью рекомбинируют при ее понижении.
Удельная теплоемкость не имеет значения, если вещество претерпевает необратимые химические изменения или если происходит фазовый переход , например плавление или кипение, при резкой температуре в диапазоне температур, охватываемом измерением.
Удельную теплоемкость вещества обычно определяют по определению; а именно, путем измерения теплоемкости образца вещества, обычно с помощью калориметра , и деления его на массу образца. Для оценки теплоемкости вещества можно применить несколько методов, например, быструю дифференциальную сканирующую калориметрию. [11] [12]
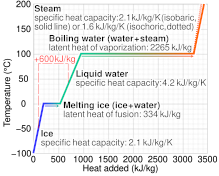
Удельную теплоемкость газов можно измерить при постоянном объеме, поместив образец в жесткий контейнер. С другой стороны, измерение удельной теплоемкости при постоянном объеме может быть непомерно трудным для жидкостей и твердых тел, поскольку часто требуется непрактичное давление, чтобы предотвратить расширение, которое может быть вызвано даже небольшим повышением температуры. Вместо этого общепринятой практикой является измерение удельной теплоемкости при постоянном давлении (позволяя материалу расширяться или сжиматься по своему желанию), определение отдельно коэффициента теплового расширения и сжимаемости материала и расчет удельной теплоемкости при постоянном давлении. объем из этих данных согласно законам термодинамики. [ нужна цитата ]
Единицей удельной теплоемкости в системе СИ является джоуль на кельвин на килограмм.Дж/кг⋅К, Дж⋅К −1 ⋅кг −1 . Поскольку приращение температуры на один градус Цельсия равно приращению на один кельвин, это то же самое, что джоуль на градус Цельсия на килограмм: Дж/(кг⋅°C). Иногда вместо килограмма в качестве единицы массы используется грамм : 1 Дж⋅г −1 ⋅К −1 = 1000 Дж⋅кг −1 ⋅К −1 .
Удельная теплоемкость вещества (на единицу массы) имеет размерность L 2 ⋅Θ −1 ⋅T −2 , или (L/T) 2 /Θ. Следовательно, единица СИ Дж⋅кг -1 ⋅К -1 эквивалентна квадратному метру на секунду в квадрате на кельвин (м 2 ⋅К -1 ⋅с -2 ).
Специалисты в области строительства , гражданского строительства , химического машиностроения и других технических дисциплин, особенно в Соединенных Штатах , могут использовать английские инженерные единицы , включая фунт (фунт = 0,45359237 кг) в качестве единицы массы, градус Фаренгейта или Ренкина (°R =5/9К, около 0,555556 К) как единица приращения температуры и британская тепловая единица (БТЕ ≈ 1055,056 Дж), [13] [14] как единица теплоты.
В этих контекстах единицей удельной теплоемкости является БТЕ/фунт⋅°R, или 1.БТЕ/фунт⋅°Р= 4186,68Дж/кг⋅К. [15] Изначально БТЕ определялась таким образом, что средняя удельная теплоемкость воды составляла 1 БТЕ/фунт⋅°F. [16] Обратите внимание на сходство значения со значением калории - 4187 Дж/кг⋅°C ≈ 4184 Дж/кг⋅°C (~ 0,07%), поскольку они, по сути, измеряют одну и ту же энергию, используя воду в качестве базовой точки отсчета. , масштабированные к соответствующим фунтам и °F или кг и °C в соответствующих системах.
В химии количество тепла часто измерялось в калориях . Как ни странно, есть две общие единицы с таким названием, обозначаемые соответственно Cal и Cal :
Хотя эти единицы все еще используются в некоторых контекстах (например, килограмм-калория в питании ), их использование в настоящее время не рекомендуется в технических и научных областях. Когда тепло измеряется в этих единицах, единицей удельной теплоемкости обычно является:
Обратите внимание , что хотя кал составляет 1 ⁄ 1000 кал или ккал, он также указан на грамм вместо килограмма : следовательно, в любой единице удельная теплоемкость воды равна примерно 1.
Температура образца вещества отражает среднюю кинетическую энергию составляющих его частиц (атомов или молекул) относительно его центра масс. Однако не вся энергия, переданная образцу вещества, пойдет на повышение его температуры, примером чего является теорема о равнораспределении .
Квантовая механика предсказывает, что при комнатной температуре и обычном давлении изолированный атом газа не может хранить сколько-нибудь значительное количество энергии, кроме как в форме кинетической энергии. Таким образом, теплоемкость на моль одинакова для всех одноатомных газов (например, благородных газов). Точнее, и , где – единица идеального газа (которая является произведением константы преобразования Больцмана из микроскопической единицы энергии Кельвина в макроскопическую единицу энергии джоуль и числа Авогадро ).
Следовательно, удельная теплоемкость (на грамм, а не на моль) одноатомного газа будет обратно пропорциональна его (аразмерному) атомному весу . То есть примерно
Для благородных газов, от гелия до ксенона, эти расчетные значения равны
С другой стороны, молекула многоатомного газа (состоящая из двух или более атомов, связанных вместе) может хранить тепловую энергию в виде кинетической энергии, а также во вращении молекулы и вибрации атомов относительно друг друга (включая внутреннюю потенциальную энергию ).
Эти дополнительные степени свободы или «режимы» способствуют удельной теплоемкости вещества. А именно, когда тепловая энергия вводится в газ с многоатомными молекулами, только часть ее пойдет на увеличение их кинетической энергии, а значит, и температуры; остальное перейдет в другие степени свободы. Для достижения такого же повышения температуры на грамм этого вещества необходимо больше тепловой энергии, чем на грамм одноатомного газа. Таким образом, удельная теплоемкость на моль многоатомного газа зависит как от молекулярной массы, так и от числа степеней свободы молекул. [18] [19] [20]
Квантовая механика далее утверждает, что каждая вращательная или колебательная мода может брать или терять энергию только в определенных дискретных количествах (квантах). В зависимости от температуры средняя тепловая энергия на молекулу может быть слишком маленькой по сравнению с количеством квантов, необходимым для активации некоторых из этих степеней свободы. Говорят, что эти режимы «заморожены». В этом случае удельная теплоемкость вещества увеличивается с температурой, иногда ступенчато, поскольку мода размораживается и начинает поглощать часть подводимой тепловой энергии.
Например, молярная теплоемкость азота N
2при постоянном объеме (при 15 °С, 1 атм), что составляет . [21] Это значение, ожидаемое согласно теории, если бы каждая молекула имела 5 степеней свободы. Это три градуса вектора скорости молекулы плюс два градуса ее вращения вокруг оси, проходящей через центр масс и перпендикулярной линии двух атомов. Из-за этих двух дополнительных степеней свободы удельная теплоемкость N
2(736 Дж⋅К -1 ⋅кг -1 ) больше, чем у гипотетического одноатомного газа с той же молекулярной массой 28 (445 Дж⋅К -1 ⋅кг -1 ), в раз5/3.
Это значение удельной теплоемкости азота практически постоянно в диапазоне от -150 °C до примерно 300 °C. В этом температурном диапазоне еще «выморожены» две дополнительные степени свободы, соответствующие колебаниям атомов, растягивающим и сжимающим связь. Примерно при этой температуре эти моды начинают «размораживаться» и в результате начинают сначала быстро расти, затем медленнее, стремясь к другому постоянному значению. Она составляет 35,5 Дж⋅К -1 ⋅моль -1 при 1500 °С, 36,9 при 2500 °С и 37,5 при 3500 °С. [22] Последнее значение почти точно соответствует предсказанному значению для 7 степеней свободы на молекулу.
Исходя из фундаментального термодинамического соотношения , можно показать:
где
Вывод обсуждается в статье «Отношения между теплоемкостью ».
Для идеального газа , если в приведенном выше уравнении выражается как молярная плотность, это уравнение сводится просто к соотношению Майера :
где и – интенсивные свойства теплоемкости, выраженные в пересчете на моль при постоянном давлении и постоянном объеме соответственно.
Удельная теплоемкость материала в пересчете на массу равна
что в отсутствие фазовых переходов эквивалентно
где
Для газов, а также для других материалов, находящихся под высоким давлением, необходимо различать различные граничные условия для рассматриваемых процессов (поскольку значения существенно различаются в разных условиях). Типичные процессы, для которых можно определить теплоемкость, включают изобарические (постоянное давление ) или изохорные (постоянный объем ) процессы. Соответствующие удельные теплоемкости выражаются как
Связанным с ним параметром является объемная теплоемкость . В инженерной практике для твердых тел или жидкостей часто означает объемную теплоемкость, а не постоянный объем. В таких случаях удельную теплоемкость часто явно записывают с индексом , как . Разумеется, из приведенных выше соотношений для твердых тел пишется
Для чистых однородных химических соединений с установленной молекулярной или молярной массой или установленным молярным количеством теплоемкость как интенсивное свойство может быть выражена в расчете на моль , а не на массу, с помощью следующих уравнений, аналогичных уравнениям на массу:
где n = количество молей в организме или термодинамической системе . Такую мольную величину можно назвать молярной теплоемкостью, чтобы отличить ее от удельной теплоемкости в пересчете на массу.
Политропная теплоемкость рассчитывается при процессах, если изменяются все термодинамические свойства (давление, объем, температура) .
Наиболее важные политропные процессы протекают между адиабатической и изотермической функциями, индекс политропы находится между 1 и показателем адиабаты ( γ или κ ).
Безразмерная теплоемкость материала равна
где
Опять же, для примера показаны единицы СИ .
Подробнее о величинах первого измерения читайте [23] на сайте BIPM.
В статье «Идеальный газ » безразмерная теплоемкость выражается как .
Из определения энтропии
абсолютную энтропию можно рассчитать путем интегрирования температуры от нуля Кельвинов до конечной температуры T f
Теплоемкость должна быть равна нулю при нулевой температуре, чтобы приведенный выше интеграл не приводил к бесконечной абсолютной энтропии, нарушая тем самым третий закон термодинамики . Одной из сильных сторон модели Дебая является то, что (в отличие от предыдущей модели Эйнштейна) она предсказывает правильную математическую форму приближения теплоемкости к нулю при приближении к абсолютной нулевой температуре.
Теоретическая максимальная теплоемкость для все более крупных многоатомных газов при более высоких температурах также приближается к пределу Дюлонга-Пти, равному 3 R , если она рассчитывается на моль атомов, а не молекул. Причина в том, что газы с очень большими молекулами теоретически обладают почти такой же высокотемпературной теплоемкостью, как и твердые тела, за исключением (небольшого) вклада в теплоемкость, который возникает за счет потенциальной энергии, которая не может храниться между отдельными молекулами в газе.
Предел Дюлонга-Пти является результатом теоремы о равнораспределении и, как таковой, действителен только в классическом пределе континуума микросостояний, который является пределом высоких температур. Для легких и неметаллических элементов, а также для большинства распространенных молекулярных твердых веществ на основе соединений углерода при стандартной температуре окружающей среды квантовые эффекты также могут играть важную роль, как и в многоатомных газах. Эти эффекты обычно в совокупности дают теплоемкость ниже 3 R на моль атомов твердого тела, хотя в молекулярных твердых телах теплоемкость, рассчитанная на моль молекул в молекулярных твердых телах, может составлять более 3 R . Например, теплоемкость водяного льда при температуре плавления составляет около 4,6 Р на моль молекул, но всего 1,5 Р на моль атомов. Число R «на атом» ниже 3 (как в случае с алмазом и бериллием) является результатом «вымораживания» возможных мод колебаний легких атомов при достаточно низких температурах, как и во многих газах с малой массой атомов при достаточно низких температурах. комнатные температуры. Из-за высоких энергий связи кристаллов эти эффекты наблюдаются в твердых телах чаще, чем в жидкостях: например, теплоемкость жидкой воды в два раза выше, чем у льда при почти той же температуре, и снова близка к 3 R на моль атомов теоретический максимум Дюлонга–Пти.
Для более современного и точного анализа теплоемкости твердых тел, особенно при низких температурах, полезно использовать идею фононов . См. Модель Дебая .
Метод Монте-Карло с интегралом по траектории представляет собой численный подход к определению значений теплоемкости, основанный на квантово-динамических принципах. Однако хорошие аппроксимации можно сделать для газов во многих состояниях, используя более простые методы, описанные ниже. Для многих твердых тел, состоящих из относительно тяжелых атомов (атомный номер > железа), при некриогенных температурах теплоемкость при комнатной температуре приближается к 3R = 24,94 джоуля на кельвин на моль атомов (закон Дюлонга – Пти, R – газовая постоянная). . Низкотемпературные аппроксимации как для газов, так и для твердых тел при температурах, меньших, чем их характерные температуры Эйнштейна или температуры Дебая, могут быть сделаны с помощью методов Эйнштейна и Дебая, обсуждаемых ниже.
Для жидкостей и газов важно знать давление, к которому относятся данные теплоемкости. Большинство опубликованных данных даны для стандартного давления. Однако разные организации установили разные стандартные условия для температуры и давления. Международный союз теоретической и прикладной химии (IUPAC) изменил свою рекомендацию с одной атмосферы на круглое значение 100 кПа (≈750,062 Торр). [примечания 1]
Метод Монте-Карло с интегралом по траектории представляет собой численный подход к определению значений теплоемкости, основанный на квантово-динамических принципах. Однако хорошие аппроксимации можно сделать для газов во многих состояниях, используя более простые методы, описанные ниже. Для многих твердых тел, состоящих из относительно тяжелых атомов (атомный номер > железа), при некриогенных температурах теплоемкость при комнатной температуре приближается к 3 R = 24,94 джоуля на кельвин на моль атомов ( закон Дюлонга – Пти , R – газовая постоянная ). Низкотемпературные аппроксимации как для газов, так и для твердых тел при температурах, меньших, чем их характерные температуры Эйнштейна или температуры Дебая, могут быть сделаны с помощью методов Эйнштейна и Дебая, обсуждаемых ниже.
Измерение удельной теплоемкости при постоянном объеме может оказаться непомерно трудным для жидкостей и твердых тел. То есть небольшие изменения температуры обычно требуют большого давления для поддержания постоянного объема жидкости или твердого вещества, а это означает, что содержащий сосуд должен быть почти жестким или, по крайней мере, очень прочным (см. Коэффициент теплового расширения и сжимаемости ). Вместо этого легче измерить теплоемкость при постоянном давлении (позволяя материалу свободно расширяться или сжиматься) и определить теплоемкость при постоянном объеме, используя математические соотношения, выведенные из основных термодинамических законов.
Коэффициент теплоемкости , или индекс адиабаты, представляет собой отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме. Иногда его также называют коэффициентом изоэнтропического расширения.
Для идеального газа оценка частных производных, приведенных выше, согласно уравнению состояния , где R — газовая постоянная , для идеального газа [24]
Замена
это уравнение просто сводится к соотношению Майера :
Различия в теплоемкостях, определенные приведенным выше соотношением Майера, точны только для идеального газа и будут другими для любого реального газа.
Удельная теплоемкость материала в пересчете на массу равна
что в отсутствие фазовых переходов эквивалентно
где
Для газов, а также для других материалов, находящихся под высоким давлением, необходимо различать различные граничные условия для рассматриваемых процессов (поскольку значения существенно различаются в разных условиях). Типичные процессы, для которых можно определить теплоемкость, включают изобарические (постоянное давление ) или изохорные (постоянный объем ) процессы. Соответствующие удельные теплоемкости выражаются как
Из результатов предыдущего раздела деление на массу дает соотношение
Связанным с ним параметром является объемная теплоемкость . В инженерной практике для твердых тел или жидкостей часто означает объемную теплоемкость, а не постоянный объем. В таких случаях удельную теплоемкость часто пишут с индексом , например . Разумеется, из приведенных выше соотношений для твердых тел пишется
Для чистых однородных химических соединений с установленной молекулярной или молярной массой или молярной величиной теплоемкость как интенсивное свойство может быть выражена в расчете на моль , а не на массу с помощью следующих уравнений, аналогичных уравнениям на массу:
где n — число молей в организме или термодинамической системе . Такую мольную величину можно назвать молярной теплоемкостью , чтобы отличить ее от удельной теплоемкости в пересчете на массу.
Политропная теплоемкость рассчитывается при процессах, если изменяются все термодинамические свойства (давление, объем, температура) :
Наиболее важные политропные процессы протекают между адиабатической и изотермической функциями, индекс политропы находится между 1 и показателем адиабаты ( γ или κ ).
Безразмерная теплоемкость материала равна
где
В идеальном газе безразмерная теплоемкость выражается как и там напрямую связана с половиной числа степеней свободы на частицу. Это справедливо для квадратичных степеней свободы, что является следствием теоремы о равнораспределении .
В более общем смысле, безразмерная теплоемкость связывает логарифмическое увеличение температуры с увеличением безразмерной энтропии на частицу , измеряемой в нац .
Альтернативно, используя логарифмы по основанию 2, связывается логарифмическое увеличение температуры по основанию 2 с увеличением безразмерной энтропии, измеряемой в битах . [25]
Из определения энтропии
абсолютную энтропию можно рассчитать путем интегрирования от нуля до конечной температуры T f :
Теоретически удельную теплоемкость вещества также можно получить на основе его абстрактного термодинамического моделирования с помощью уравнения состояния и функции внутренней энергии.
Для применения теории рассматривается образец вещества (твердое, жидкое или газообразное), для которого можно определить удельную теплоемкость; в частности, что он имеет однородный состав и фиксированную массу . Предположим, что эволюция системы всегда происходит достаточно медленно, чтобы внутреннее давление и температуру можно было считать однородными. Давление будет равно давлению, оказываемому на него корпусом или какой-либо окружающей жидкостью, например воздухом.
Состояние материала затем можно определить с помощью трех параметров: его температуры , давления и его удельного объема , где — объем образца. (Эта величина обратна плотности материала .) Как и , удельный объем является интенсивным свойством материала и его состояния, не зависящим от количества вещества в образце.
Эти переменные не являются независимыми. Разрешенные состояния определяются уравнением состояния , связывающим эти три переменные: Функция зависит от рассматриваемого материала. Удельная внутренняя энергия , запасенная внутри образца на единицу массы, будет тогда другой функцией этих переменных состояния, которая также зависит от материала. Тогда полная внутренняя энергия образца составит .
Для некоторых простых материалов, таких как идеальный газ , из базовой теории можно вывести уравнение состояния и даже удельную внутреннюю энергию. В общем, эти функции должны быть определены экспериментально для каждого вещества.
Абсолютное значение этой величины не определено, и (для целей термодинамики) состояние «нулевой внутренней энергии» может быть выбрано произвольно. Однако по закону сохранения энергии любое бесконечно малое увеличение полной внутренней энергии должно сопровождаться чистым притоком тепловой энергии в образец плюс любой чистой механической энергией, обеспечиваемой ему корпусом или окружающей средой на нем. Последний равен , где – изменение объема образца за этот бесконечно малый шаг. [26] Поэтому
следовательно
Если объем образца (следовательно, удельный объем материала) остается постоянным во время введения количества тепла , то этот член равен нулю (механическая работа не совершается). Тогда, разделив на ,
где – изменение температуры, вызванное подводом тепла. Левая часть представляет собой удельную теплоемкость при постоянном объеме материала.
Для теплоемкости при постоянном давлении полезно определить удельную энтальпию системы как сумму . Тогда бесконечно малое изменение удельной энтальпии будет
поэтому
Если давление поддерживается постоянным, второй член в левой части равен нулю, и
В левой части — удельная теплоемкость при постоянном давлении материала.
В общем, бесконечно малые величины ограничиваются уравнением состояния и конкретной функцией внутренней энергии. А именно,
Здесь обозначает (частную) производную уравнения состояния по его аргументу, сохраняя фиксированными два других аргумента, оцениваемых в рассматриваемом состоянии. Остальные частные производные определяются аналогично. Эти два уравнения для четырех бесконечно малых приращений обычно ограничивают их двумерным линейным подпространством возможных бесконечно малых изменений состояния, которое зависит от материала и состояния. Изменения постоянного объема и постоянного давления — это только два конкретных направления в этом пространстве.
Этот анализ также справедлив независимо от того, каким образом приращение энергии вводится в образец, а именно за счет теплопроводности , облучения, электромагнитной индукции , радиоактивного распада и т. д.
Для любого удельного объема обозначьте функцию, которая описывает, как давление меняется в зависимости от температуры , как это допускается уравнением состояния, когда удельный объем материала принудительно поддерживается постоянным на уровне . Аналогично, для любого давления пусть будет функцией, которая описывает, как удельный объем изменяется с температурой, когда давление поддерживается постоянным на уровне . А именно, эти функции таковы, что
для любых значений . Другими словами, графики и представляют собой срезы поверхности, определяемые уравнением состояния, рассеченные плоскостями констант и констант соответственно.
Тогда из фундаментального термодинамического соотношения следует, что
Это уравнение можно переписать как
где
и то и другое в зависимости от штата .
Коэффициент теплоемкости , или индекс адиабаты, представляет собой отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме. Иногда его также называют коэффициентом изоэнтропического расширения.
Метод Монте-Карло с интегралом по траектории представляет собой численный подход к определению значений теплоемкости, основанный на квантово-динамических принципах. Однако хорошие аппроксимации можно сделать для газов во многих состояниях, используя более простые методы, описанные ниже. Для многих твердых тел, состоящих из относительно тяжелых атомов (атомный номер > железа), при некриогенных температурах теплоемкость при комнатной температуре приближается к 3 R = 24,94 джоуля на кельвин на моль атомов ( закон Дюлонга – Пти , R – газовая постоянная ). Низкотемпературные аппроксимации как для газов, так и для твердых тел при температурах, меньших, чем их характерные температуры Эйнштейна или температуры Дебая, могут быть сделаны с помощью методов Эйнштейна и Дебая, обсуждаемых ниже. Однако следует обратить внимание на последовательность таких первопринципных соображений при их использовании вместе с уравнением состояния рассматриваемого материала. [27]
Для идеального газа оценка частных производных, приведенных выше, согласно уравнению состояния , где R — газовая постоянная , для идеального газа [28]
Замена
это уравнение просто сводится к соотношению Майера :
Различия в теплоемкостях, определенные приведенным выше соотношением Майера, точны только для идеального газа и будут другими для любого реального газа.
{{cite book}}: CS1 maint: multiple names: authors list (link)Прилагательное видовое перед названием обширной величины часто употребляется в значении разделенного на массу.
{{cite book}}: CS1 maint: multiple names: authors list (link)