
Фаза G0 описывает состояние клетки вне репликативного клеточного цикла . Классически [ когда? ] считалось, что клетки попадают в G 0 в первую очередь из-за факторов окружающей среды, таких как лишение питательных веществ, которое ограничивает ресурсы, необходимые для пролиферации. Таким образом, это считалось фазой покоя . Теперь известно, что G 0 принимает разные формы и возникает по множеству причин. Например, большинство взрослых нейрональных клеток, среди наиболее метаболически активных клеток организма, полностью дифференцированы и находятся в терминальной G0- фазе . Нейроны находятся в этом состоянии не из-за стохастического или ограниченного поступления питательных веществ, а в рамках своей программы развития.
G0 был впервые предложен как состояние клетки на основе ранних исследований клеточного цикла. Когда первые исследования определили четыре фазы клеточного цикла с использованием методов радиоактивного мечения, было обнаружено, что не все клетки в популяции размножаются с одинаковой скоростью. [1] «Фракция роста» популяции – или часть популяции, которая росла – активно пролиферировала, но другие клетки существовали в непролиферативном состоянии. Некоторые из этих непролиферирующих клеток могут реагировать на внешние стимулы и размножаться, повторно вступая в клеточный цикл. [2] Ранние противоположные взгляды либо считали, что непролиферирующие клетки просто находятся в расширенной фазе G 1 , либо в фазе клеточного цикла, отличной от G 1 и называемой G 0 . [3] Последующие исследования указали на точку ограничения (R-точку) в G 1 , где клетки могут войти в G 0 до точки R, но начинают митоз после точки R. [4] Эти ранние исследования предоставили доказательства существования состояния G 0 , доступ к которому ограничен. Эти клетки, которые не делятся дальше, выходят из фазы G 1 и переходят в неактивную стадию, называемую стадией покоя.

Существуют три состояния G 0 , которые можно разделить на обратимые (покойные) и необратимые ( стареющие и дифференцированные ). В каждое из этих трех состояний можно войти из фазы G 1 до того, как клетка перейдет к следующему раунду клеточного цикла. Покой относится к обратимому состоянию G 0 , при котором субпопуляции клеток находятся в «покоящемся» состоянии перед входом в клеточный цикл после активации в ответ на внешние сигналы. Покоящиеся клетки часто идентифицируются по низкому содержанию РНК , отсутствию маркеров клеточной пролиферации и повышенному удерживанию метки, что указывает на низкий оборот клеток. [5] [6] Старение отличается от покоя, поскольку старение — это необратимое состояние, в которое клетки входят в ответ на повреждение или деградацию ДНК, что делает потомство клетки нежизнеспособным. Такое повреждение ДНК может произойти в результате укорочения теломер во многих клеточных делениях, а также воздействия активных форм кислорода (АФК), активации онкогенов и слияния клеток. Хотя стареющие клетки больше не могут размножаться, они по-прежнему способны выполнять многие нормальные клеточные функции. [7] [8] [9] [10] Старение часто является биохимической альтернативой самоуничтожению такой поврежденной клетки путем апоптоза . В отличие от клеточного старения, покой – это не реактивное событие, а часть основного программирования нескольких различных типов клеток. Наконец, дифференцированные клетки — это стволовые клетки, которые прошли программу дифференцировки и достигли зрелого — окончательно дифференцированного — состояния. Дифференцированные клетки продолжают оставаться в G 0 и выполнять свои основные функции неопределенно долго.
Транскриптомы нескольких типов покоящихся стволовых клеток, таких как гемопоэтические , мышечные и волосяные фолликулы, были охарактеризованы с помощью высокопроизводительных методов , таких как микрочипы и секвенирование РНК . Хотя в их индивидуальных транскриптомах существуют вариации, большинство стволовых клеток покоящихся тканей имеют общий паттерн экспрессии генов, который включает подавление генов прогрессирования клеточного цикла, таких как циклин А2 , циклин В1 , циклин Е2 и сурвивин , а также активацию генов, участвующих в регуляция транскрипции и судьбы стволовых клеток, таких как FOXO3 и EZH1 . Понижение уровня митохондриального цитохрома С также отражает низкое метаболическое состояние покоящихся стволовых клеток. [11]
Многие покоящиеся стволовые клетки, особенно взрослые стволовые клетки , также имеют схожие эпигенетические паттерны. Например, H3K4me3 и H3K27me3 — два основных паттерна метилирования гистонов , которые образуют двухвалентный домен и расположены вблизи сайтов инициации транскрипции. Было обнаружено, что эти эпигенетические маркеры регулируют принятие решений о происхождении эмбриональных стволовых клеток, а также контролируют состояние покоя в волосяных фолликулах и мышечных стволовых клетках посредством модификации хроматина . [11]
Функциональные гены-супрессоры опухолей , особенно ген p53 и Rb , необходимы для поддержания покоя стволовых клеток и предотвращения истощения пула клеток-предшественников из-за чрезмерных делений. Например, было показано, что удаление всех трех компонентов семейства белков Rb останавливает состояние покоя в гемопоэтических стволовых клетках. Было показано, что отсутствие р53 предотвращает дифференцировку этих стволовых клеток из-за неспособности клеток выйти из клеточного цикла в фазу G0 . Помимо p53 и Rb, для поддержания покоя также важны ингибиторы циклинзависимых киназ (CKI), такие как p21 , p27 и p57 . В гемопоэтических стволовых клетках мыши нокаут р57 и р27 приводит к выходу G0 посредством ядерного импорта циклина D1 и последующего фосфорилирования Rb. Наконец, было показано, что сигнальный путь Notch играет важную роль в поддержании покоя. [11]
Было показано , что посттранскрипционная регуляция экспрессии генов посредством синтеза микроРНК играет не менее важную роль в поддержании покоя стволовых клеток. Нити микроРНК связываются с 3'-нетранслируемой областью ( 3'-UTR ) целевых мРНК , предотвращая их трансляцию в функциональные белки. Длина 3'-UTR гена определяет его способность связываться с нитями микроРНК, тем самым позволяя регулировать состояние покоя. Некоторые примеры микроРНК в стволовых клетках включают миР-126, которая контролирует путь PI3K/AKT/mTOR в гемопоэтических стволовых клетках, миР-489, которая подавляет онкоген DEK в мышечных стволовых клетках, и миР-31, которая регулирует Myf5 в мышцах. стволовые клетки. Секвестрация мРНК микроРНК внутри рибонуклеопротеиновых комплексов позволяет покоящимся клеткам хранить мРНК, необходимую для быстрого входа в фазу G1 . [11]
Стволовые клетки, которые долгое время находились в состоянии покоя, часто сталкиваются с различными стрессорами окружающей среды, такими как окислительный стресс . Однако несколько механизмов позволяют этим клеткам реагировать на такие стрессоры. Например, факторы транскрипции FOXO реагируют на присутствие активных форм кислорода (АФК), тогда как HIF1A и LKB1 реагируют на гипоксические условия. В гемопоэтических стволовых клетках аутофагия индуцируется в ответ на метаболический стресс. [11]
Стволовые клетки — это клетки с уникальной способностью производить дифференцированные дочерние клетки и сохранять свою идентичность стволовых клеток посредством самообновления. [12] У млекопитающих большинство тканей взрослого человека содержат тканеспецифические стволовые клетки , которые находятся в тканях и размножаются для поддержания гомеостаза на протяжении всей жизни организма. Эти клетки могут подвергаться огромной пролиферации в ответ на повреждение тканей, прежде чем дифференцироваться и участвовать в регенерации. Некоторые тканевые стволовые клетки существуют в обратимом состоянии покоя неопределенно долго, пока не будут активированы внешними раздражителями. Существует множество различных типов тканевых стволовых клеток, включая мышечные стволовые клетки (МСК), нервные стволовые клетки (НСК), кишечные стволовые клетки (ИСК) и многие другие.
Недавно было высказано предположение, что покой стволовых клеток состоит из двух отдельных функциональных фаз: G 0 и фазы «настороженности», называемой G Alert . [13] Считается, что стволовые клетки активно и обратимо переходят между этими фазами, чтобы реагировать на раздражители повреждения и, по-видимому, приобретают усиленную регенеративную функцию тканей в G Alert . Таким образом, переход в режим G Alert был предложен как адаптивный ответ, который позволяет стволовым клеткам быстро реагировать на повреждение или стресс, подготавливая их к входу в клеточный цикл. Было идентифицировано , что в мышечных стволовых клетках активность mTORC1 контролирует переход от G 0 к G Alert наряду с передачей сигналов через рецептор HGF cMet . [13]
Хотя обратимое состояние покоя, пожалуй, наиболее важно для тканевых стволовых клеток, чтобы быстро реагировать на стимулы и поддерживать правильный гомеостаз и регенерацию, обратимые фазы G0 можно обнаружить в нестволовых клетках, таких как зрелые гепатоциты. [14] В нормальной печени гепатоциты обычно находятся в состоянии покоя, но подвергаются ограниченной репликации (менее 2 клеточных делений) во время регенерации печени после частичной гепатэктомии. Однако в некоторых случаях гепатоциты могут испытывать огромную пролиферацию (более 70 делений клеток), что указывает на то, что их способность к пролиферации не снижается из-за существования в обратимом состоянии покоя. [14]
Стареющие клетки, часто связанные со старением и возрастными заболеваниями in vivo, можно обнаружить во многих возобновляемых тканях, включая строму , сосудистую сеть , кроветворную систему и многие эпителиальные органы. В результате накопления во многих клеточных делениях старение часто наблюдается при возрастных дегенеративных фенотипах. Было обнаружено, что стареющие фибробласты в моделях функции эпителиальных клеток молочной железы нарушают выработку молочного белка из-за секреции матриксных металлопротеиназ . [15] Аналогичным образом, стареющие гладкомышечные клетки легочной артерии вызывают пролиферацию и миграцию близлежащих гладкомышечных клеток, что, возможно, способствует гипертрофии легочных артерий и, в конечном итоге, легочной гипертензии. [16]
Во время скелетного миогенеза циклические клетки-предшественники, известные как миобласты , дифференцируются и сливаются вместе в нециклические мышечные клетки, называемые миоцитами, которые остаются в терминальной G0- фазе . [17] В результате волокна, составляющие скелетные мышцы (миофибриллы), представляют собой клетки с несколькими ядрами, называемые миоядрами, поскольку каждое миоядро происходит из одного миобласта. Клетки скелетных мышц продолжают бесконечно обеспечивать сократительную силу посредством одновременных сокращений клеточных структур, называемых саркомерами . Важно отметить, что эти клетки остаются в терминальной фазе G0, поскольку нарушение структуры мышечных волокон после их образования может препятствовать правильной передаче силы по длине мышцы. Рост мышц может стимулироваться ростом или травмой и включает вовлечение мышечных стволовых клеток, также известных как клетки-сателлиты, из обратимого состояния покоя. Эти стволовые клетки дифференцируются и сливаются, образуя новые мышечные волокна как параллельно, так и последовательно, увеличивая способность генерировать силу.
Сердечная мышца также формируется посредством миогенеза, но вместо того, чтобы рекрутировать стволовые клетки для слияния и образования новых клеток, клетки сердечной мышцы, известные как кардиомиоциты , просто увеличиваются в размерах по мере того, как сердце становится больше. Как и в случае со скелетными мышцами, если бы кардиомиоцитам пришлось продолжать делиться, чтобы добавить мышечную ткань, сократительные структуры, необходимые для работы сердца, были бы нарушены.
Из четырех основных типов костных клеток остеоциты являются наиболее распространенными и также существуют в терминальной G0 - фазе. Остеоциты возникают из остеобластов, которые заключены в самосекретируемый матрикс. Хотя остеоциты также имеют пониженную синтетическую активность, они по-прежнему выполняют функции кости, помимо создания структуры. Остеоциты действуют посредством различных механосенсорных механизмов, помогая в обычном обновлении костного матрикса.
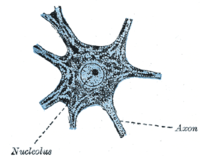
За исключением нескольких нейрогенных ниш в головном мозге, большинство нейронов полностью дифференцированы и находятся в терминальной G0 - фазе. Эти полностью дифференцированные нейроны образуют синапсы , в которых электрические сигналы передаются по аксонам к дендритам близлежащих нейронов. В этом состоянии G0 нейроны продолжают функционировать до старения или апоптоза. Многочисленные исследования показали накопление повреждений ДНК с возрастом, особенно окислительных повреждений , в мозге млекопитающих . [18]
Впервые было обнаружено, что Rim15 играет решающую роль в инициации мейоза в диплоидных дрожжевых клетках. В условиях низкого содержания глюкозы и азота, которые являются ключевыми питательными веществами для выживания дрожжей, диплоидные дрожжевые клетки инициируют мейоз посредством активации ранних мейотически-специфичных генов (EMG). Экспрессия ЭМГ регулируется Ume6. Ume6 рекрутирует деацетилазы гистонов , Rpd3 и Sin3, для подавления экспрессии ЭМГ, когда уровни глюкозы и азота высоки, и рекрутирует фактор транскрипции ЭМГ Ime1, когда уровни глюкозы и азота низкие. Rim15, названный в честь его роли в регуляции ЭМГ, называемой IME2, вытесняет Rpd3 и Sin3, тем самым позволяя Ume6 доставлять Ime1 к промоторам ЭМГ для инициации мейоза. [19]
Помимо того, что Rim15 играет роль в инициации мейоза, также показано, что он является критическим эффектором для входа дрожжевых клеток в G0 в присутствии стресса. Сигналы от нескольких различных сигнальных путей питательных веществ сходятся на Rim15, который активирует факторы транскрипции Gis1, Msn2 и Msn4. Gis1 связывается и активирует промоторы, содержащие элементы постдиауктического сдвига роста (PDS), тогда как Msn2 и Msn4 связываются и активируют промоторы, содержащие элементы стресс-реакции (STRE). Хотя неясно, как Rim15 активирует Gis1 и Msn2/4, есть некоторые предположения, что он может непосредственно фосфорилировать их или участвовать в ремоделировании хроматина. Также было обнаружено, что Rim15 содержит домен PAS на своем N-конце , что делает его недавно открытым членом семейства PAS- киназ . Домен PAS является регуляторной единицей белка Rim15, которая может играть роль в чувствительности к окислительному стрессу у дрожжей. [19]
Дрожжи растут в геометрической прогрессии за счет ферментации глюкозы. Когда уровень глюкозы падает, дрожжи переходят от ферментации к клеточному дыханию , метаболизируя продукты ферментации из фазы экспоненциального роста. Этот сдвиг известен как диауксический сдвиг, после которого дрожжи входят в G0 . Когда уровни глюкозы в окружающей среде высоки, выработка цАМФ по пути RAS-цАМФ-ПКА ( цАМФ-зависимый путь ) увеличивается, в результате чего протеинкиназа А (ПКА) ингибирует свою нижестоящую мишень Rim15 и обеспечивает пролиферацию клеток. Когда уровень глюкозы падает, выработка цАМФ снижается, снимая ингибирование Rim15 со стороны PKA и позволяя дрожжевым клеткам проникать в G0 . [19]
Помимо глюкозы, наличие азота имеет решающее значение для пролиферации дрожжей. В условиях низкого содержания азота Rim15 активируется, способствуя остановке клеточного цикла посредством инактивации протеинкиназ TORC1 и Sch9. Хотя TORC1 и Sch9 принадлежат к двум разным путям, а именно путям, индуцируемым TOR и ферментируемой ростовой средой соответственно, обе протеинкиназы действуют, способствуя удержанию Rim15 в цитоплазме. В нормальных условиях Rim15 прикрепляется к цитоплазматическому белку 14-3-3 , Bmh2, посредством фосфорилирования его Thr1075. TORC1 инактивирует определенные фосфатазы в цитоплазме, удерживая Rim15 прикрепленным к Bmh2, в то время как считается, что Sch9 способствует удержанию Rim15 в цитоплазме посредством фосфорилирования другого сайта связывания 14-3-3, близкого к Thr1075. Когда внеклеточный азот низкий, TORC1 и Sch9 инактивируются, обеспечивая дефосфорилирование Rim15 и его последующий транспорт в ядро, где он может активировать факторы транскрипции, участвующие в продвижении входа клеток в G 0 . Также было обнаружено, что Rim15 способствует собственному экспорту из ядра посредством аутофосфорилирования . [19]
Дрожжевые клетки реагируют на низкие уровни внеклеточных фосфатов, активируя гены, которые участвуют в производстве и повышении регуляции неорганического фосфата. Путь PHO участвует в регуляции уровня фосфатов. В нормальных условиях дрожжевой циклин-зависимый киназный комплекс Pho80-Pho85 инактивирует транскрипционный фактор Pho4 посредством фосфорилирования. Однако когда уровень фосфатов падает, Pho81 ингибирует Pho80-Pho85, позволяя Pho4 быть активным. Когда фосфата много, Pho80-Pho85 также ингибирует ядерный пул Rim 15, способствуя фосфорилированию его сайта связывания Thr1075 Bmh2. Таким образом, Pho80-Pho85 действует совместно с Sch9 и TORC1, способствуя сохранению цитоплазмы Rim15 в нормальных условиях. [19]
Переходу из фазы G1 в фазу S способствует инактивация Rb посредством его прогрессивного гиперфосфорилирования комплексами циклин D/Cdk4 и циклин E /Cdk2 в поздней фазе G1 . Ранние наблюдения о том, что потеря Rb способствует повторному входу в клеточный цикл в клетках G0, позволяют предположить, что Rb также важен для регуляции перехода G0 в G1 в покоящихся клетках. [20] Дальнейшие наблюдения показали, что уровни мРНК циклина C являются самыми высокими, когда клетки человека выходят из G 0 , что позволяет предположить, что циклин C может участвовать в фосфорилировании Rb, чтобы способствовать повторному входу в клеточный цикл задержанных G 0 клеток. Анализы киназы иммунопреципитации показали, что циклин C обладает киназной активностью Rb. Более того, в отличие от циклинов D и E, Rb-киназная активность циклина C является самой высокой во время ранних фаз G 1 и самой низкой во время поздних фаз G 1 и S, что позволяет предположить, что она может участвовать в переходе от G 0 к G 1 . Использование сортировки клеток, активируемой флуоресценцией, для идентификации клеток G0 , которые характеризуются высоким соотношением ДНК и РНК по сравнению с клетками G1 , подтвердило подозрение, что циклин C способствует выходу G0 в результате репрессии эндогенного циклина C с помощью РНКи у млекопитающих. клеток увеличивала долю клеток, арестованных в G 0 . Дальнейшие эксперименты, включающие мутацию Rb в определенных сайтах фосфорилирования, показали, что фосфорилирование Rb циклином C по S807/811 необходимо для выхода G0 . Однако остается неясным, достаточен ли этот паттерн фосфорилирования для выхода G0. Наконец, анализы совместной иммунопреципитации показали, что циклин-зависимая киназа 3 (cdk3) способствует выходу G 0 путем образования комплекса с циклином C для фосфорилирования Rb по S807/811. Интересно, что S807/811 также являются мишенями фосфорилирования циклина D/cdk4 во время перехода G 1 в S. Это может указывать на возможную компенсацию активности cdk3 с помощью cdk4, особенно в свете наблюдения, что выход G0 только задерживается, а не постоянно ингибируется в клетках, лишенных cdk3, но функционирующих в cdk4. Несмотря на перекрытие целей фосфорилирования, кажется, что cdk3 все еще необходим для наиболее эффективного перехода от G 0 к G 1 . [21]
Исследования показывают, что репрессия Rb семейства транскрипционных факторов E2F регулирует переход от G0 к G1 так же, как и переход от G1 к S. Активирующие комплексы E2F связаны с рекрутированием ацетилтрансфераз гистонов , которые активируют экспрессию генов, необходимую для входа G 1 , тогда как комплексы E2F4 рекрутируют деацетилазы гистонов, которые подавляют экспрессию генов. Фосфорилирование Rb комплексами Cdk обеспечивает его диссоциацию от транскрипционных факторов E2F и последующую экспрессию генов, необходимых для выхода G0 . Было обнаружено, что другие члены семейства карманных белков Rb , такие как p107 и p130, также участвуют в аресте G0 . Уровни p130 повышены в G0 и , как было обнаружено, связываются с комплексами E2F-4, подавляя транскрипцию генов-мишеней E2F. Между тем, было обнаружено, что р107 спасает фенотип остановки клеток после потери Rb, хотя р107 экспрессируется на сравнительно низких уровнях в клетках G0 . В совокупности эти данные позволяют предположить, что репрессия Rb транскрипционных факторов E2F способствует остановке клеток, в то время как фосфорилирование Rb приводит к выходу G0 посредством дерепрессии генов-мишеней E2F. [20] Было также показано, что помимо регуляции E2F Rb подавляет РНК-полимеразу I и РНК-полимеразу III , которые участвуют в синтезе рРНК . Т.о., фосфорилирование Rb также позволяет активировать синтез рРНК, который имеет решающее значение для синтеза белка при входе в G1 . [21]