.JPG/440px-Old_drawing_of_a_Chlorine-Caustic_Soda_Plant_(Edgewood,_Maryland).JPG)
Процесс хлорщелочного производства (также хлорщелочной и хлорщелочной ) — это промышленный процесс электролиза растворов хлорида натрия (NaCl). Это технология, используемая для производства хлора и гидроксида натрия (каустической соды) [1] , которые являются товарными химикатами, необходимыми для промышленности. Тридцать пять миллионов тонн хлора были получены этим процессом в 1987 году. [2] В 2022 году это количество возросло примерно до 83 миллионов тонн. Хлор и гидроксид натрия, полученные в этом процессе, широко используются в химической промышленности.
Обычно процесс проводится на рассоле (водный раствор концентрированного NaCl), в результате чего получается гидроксид натрия (NaOH), водород и хлор. При использовании хлорида кальция или хлорида калия продукты содержат кальций или калий вместо натрия. Известны родственные процессы, в которых расплавленный NaCl используется для получения хлора и металлического натрия или конденсированный хлористый водород для получения водорода и хлора.
Процесс имеет высокое потребление энергии, например, около 2500 кВт·ч (9000 МДж) электроэнергии на тонну произведенного гидроксида натрия. Поскольку процесс дает эквивалентные количества хлора и гидроксида натрия (два моля гидроксида натрия на моль хлора), необходимо найти применение этим продуктам в той же пропорции. На каждый моль произведенного хлора производится один моль водорода. Большая часть этого водорода используется для производства соляной кислоты , аммиака , перекиси водорода или сжигается для производства электроэнергии и/или пара. [3]
Процесс хлорщелочного производства используется с 19 века и является основной отраслью промышленности в Соединенных Штатах , Западной Европе и Японии . [4] [5] Он стал основным источником хлора в 20 веке. [6] Процесс с использованием диафрагменных ячеек и процесс с использованием ртутных ячеек используются уже более 100 лет, но они небезопасны для окружающей среды из-за использования асбеста и ртути соответственно. Процесс с использованием мембранных ячеек, который был разработан только за последние 60 лет, является превосходным методом с его улучшенной энергоэффективностью и отсутствием вредных химикатов. [5]
Хотя первое образование хлора электролизом рассола было приписано химику Уильяму Крукшенку в 1800 году, только 90 лет спустя электролитический метод был успешно использован в коммерческих масштабах. Производство в промышленных масштабах началось в 1892 году. [7] В 1833 году Фарадей сформулировал законы, которые управляли электролизом водных растворов, и патенты были выданы Куку и Уатту в 1851 году и Стэнли в 1853 году на электролитическое производство хлора из рассола. [7]

Используются три метода производства. В то время как метод ртутной ячейки производит гидроксид натрия без хлора, использование нескольких тонн ртути приводит к серьезным экологическим проблемам. В обычном производственном цикле выбрасывается несколько сотен фунтов ртути в год, которые накапливаются в окружающей среде. Кроме того, хлор и гидроксид натрия, полученные с помощью процесса хлорщелочного производства с ртутной ячейкой, сами загрязнены следовыми количествами ртути. Мембранный и диафрагменный методы не используют ртуть, но гидроксид натрия содержит хлор, который необходимо удалить.
Наиболее распространенный хлорщелочной процесс включает электролиз водного раствора хлорида натрия ( рассола ) в мембранной ячейке . Мембрана, такая как Nafion , Flemion или Aciplex, используется для предотвращения реакции между ионами хлора и гидроксида.
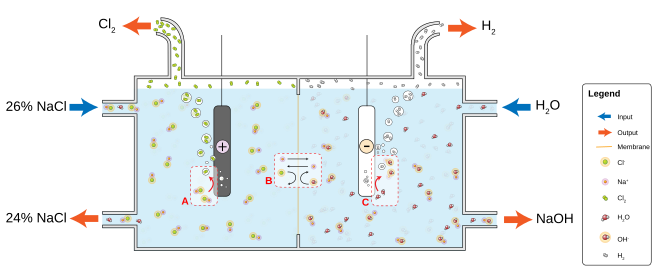
Насыщенный рассол подается в первую камеру ячейки. Из-за более высокой концентрации ионов хлора в рассоле, ионы хлора окисляются на аноде , теряя электроны и превращаясь в газообразный хлор ( A на рисунке):
На катоде положительные ионы водорода, вытягиваемые из молекул воды, восстанавливаются электронами, поставляемыми электролитическим током, до газообразного водорода, высвобождая гидроксид- ионы в раствор ( С на рисунке):
Ионообменная мембрана, проницаемая для ионов , в центре ячейки пропускает во вторую камеру только ионы натрия (Na + ), где они реагируют с гидроксид-ионами, образуя едкий натр (NaOH) ( B на рисунке): [1]
Na + + ОН − → NaOH
Общая реакция электролиза рассола выглядит следующим образом:
В процессе с диафрагменной ячейкой есть два отсека, разделенных проницаемой диафрагмой, часто сделанной из асбестовых волокон . Рассол вводится в анодный отсек и течет в катодный отсек. Подобно мембранной ячейке, ионы хлора окисляются на аноде с образованием хлора, а на катоде вода расщепляется на каустическую соду и водород. Диафрагма предотвращает реакцию каустической соды с хлором. Разбавленный каустический рассол покидает ячейку. Каустическую соду обычно необходимо концентрировать до 50%, а соль удалить. Это делается с помощью испарительного процесса с примерно тремя тоннами пара на тонну каустической соды. Соль, отделенная от каустического рассола, может использоваться для насыщения разбавленного рассола. Хлор содержит кислород и часто должен быть очищен путем сжижения и испарения.

В процессе ртутной ячейки, также известном как процесс Кастнера-Келлнера , насыщенный соляной раствор плавает поверх тонкого слоя ртути. Ртуть является катодом, где производится натрий и образует амальгаму с ртутью. Амальгама непрерывно вытягивается из ячейки и реагирует с водой, которая разлагает амальгаму на гидроксид натрия, водород и ртуть. Ртуть перерабатывается в электролитическую ячейку. Хлор производится на аноде и выходит пузырьками из ячейки. Ртутные ячейки постепенно выводятся из эксплуатации из-за опасений по поводу высокой токсичности ртути и отравления ртутью из-за загрязнения ртутными ячейками, например, как это произошло в Канаде (см. Болезнь Минамата в Онтарио ) и Японии (см. Болезнь Минамата ).
Первоначальная общая реакция производит гидроксид, а также водород и хлор: [8]
Без мембраны ионы OH − , образующиеся на катоде, могут свободно диффундировать по всему электролиту. По мере того, как электролит становится более основным из-за образования OH − , из раствора выделяется меньше Cl 2 , поскольку он начинает диспропорционировать , образуя ионы хлорида и гипохлорита на аноде:
Чем больше возможностей у Cl 2 для взаимодействия с NaOH в растворе, тем меньше Cl 2 выходит на поверхность раствора и тем быстрее происходит образование гипохлорита. Это зависит от таких факторов, как температура раствора, время контакта молекулы Cl 2 с раствором и концентрация NaOH.
Аналогично, по мере увеличения концентрации гипохлорита из него образуются хлораты:
Эта реакция ускоряется при температурах выше примерно 60 °C. Происходят и другие реакции, такие как самоионизация воды и разложение гипохлорита на катоде, скорость последнего зависит от таких факторов, как диффузия и площадь поверхности катода, контактирующая с электролитом. [9]
Если ток прерывается, когда катод погружен, катоды, подверженные воздействию гипохлоритов, например, изготовленные из нержавеющей стали, растворяются в неразделенных ячейках.
Если производство водорода и кислорода не является приоритетом, добавление 0,18% хромата натрия или калия в электролит повысит эффективность производства других продуктов. [9]
Из-за коррозионной природы производства хлора анод (где образуется хлор) должен быть нереактивным и изготавливался из таких материалов, как металлическая платина , [10] графит (называемый плюмбаго во времена Фарадея), [10] или платинированный титан . [11] Титановый анод , покрытый смешанным оксидом металла (также называемый размерно стабильным анодом), сегодня является промышленным стандартом. Исторически в качестве анодов также использовались платина, магнетит , диоксид свинца , [12] диоксид марганца и ферросилиций (13–15% кремния [13] ). [14] Платина, легированная иридием, более устойчива к коррозии от хлора, чем чистая платина. [14] [15] Неплакированный титан нельзя использовать в качестве анода, потому что он анодируется , образуя непроводящий оксид и пассивируясь . Графит будет медленно распадаться из-за внутреннего электролитического производства газа из-за пористой природы материала и углекислого газа, образующегося из-за окисления углерода, в результате чего мелкие частицы графита будут взвешены в электролите, который можно удалить фильтрацией. Катод (где образуется гидроксид) может быть изготовлен из нелегированного титана, графита или более легко окисляемого металла, такого как нержавеющая сталь или никель .
Интересы производителей хлорщелочной продукции представляют на региональном, национальном и международном уровнях такие ассоциации, как Euro Chlor и Всемирный совет по хлору .