Дицианоаурат калия (или цианид золота калия ) — неорганическое соединение с формулой K[Au( CN ) 2 ] . Это бесцветное или белое твердое вещество, растворимое в воде и слабо растворимое в спирте . Сама соль часто не выделяется, но растворы иона дицианоаурата ( [ Au(CN) 2 ] − ) производятся в больших масштабах при извлечении золота из руд. [3]
При добыче золота из разбавленных источников, золото селективно извлекается путем растворения в водных растворах цианида, полученных путем растворения цианида натрия, цианида калия и/или цианида кальция . Реакция растворения золота, «уравнение Эльснера», выглядит следующим образом:
В этом процессе окислителем является кислород. [4]
Его также можно получить путем реакции солей золота(I) с избытком цианида калия.
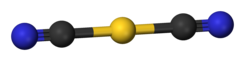
Дицианоаурат калия — это соль. Анион дицианоаурата линейный по данным рентгеновской кристаллографии . [3] На основе инфракрасной спектроскопии анион дицианоаурата принимает очень похожую структуру в дицианоаурате натрия ( NaAu(CN) 2 ). [5]
Дицианоаурат — это растворимый вид, который находится в центре внимания цианирования золота , гидрометаллургического процесса извлечения золота из разбавленных руд. Фактически, цианид натрия, а не калийная соль, более широко используется в коммерческих процессах. [6]
Помимо своего основного применения в качестве промежуточного продукта при извлечении золота, дицианоаурат калия часто используется в процессах золотого покрытия .
Известно также соединение, содержащее цианид золота(III): тетрацианоаурат(III) калия, K[Au(CN) 4 ] . Его применение менее распространено.
Ион калия может быть заменен катионами четвертичного аммония, как в дицианоаурате тетрабутиламмония . [7]
Прием внутрь граммовых количеств дицианоаурата калия может привести к смерти из-за золота, которое ингибирует фермент роданезу , который организм использует для детоксикации цианида. [8]