
Конформации циклогексана — это любая из нескольких трехмерных форм, принимаемых молекулами циклогексана . Поскольку многие соединения имеют структурно схожие шестичленные кольца , структура и динамика циклогексана являются важными прототипами широкого спектра соединений. [1] [2]
Внутренние углы правильного плоского шестиугольника составляют 120°, тогда как предпочтительный угол между последовательными связями в углеродной цепи составляет около 109,5°, тетраэдрический угол ( арксикосинус —1/3). Следовательно, циклогексановое кольцо имеет тенденцию принимать неплоские (искривленные) конформации , все углы которых ближе к 109,5 ° и, следовательно, более низкую энергию деформации , чем плоская шестиугольная форма.
Рассмотрим атомы углерода с номерами от 1 до 6 вокруг кольца. Если мы удержим атомы углерода 1, 2 и 3 неподвижными, с правильной длиной связи и тетраэдрическим углом между двумя связями, а затем продолжим, добавляя атомы углерода 4, 5 и 6 с правильной длиной связи и тетраэдрическим углом, мы можем варьировать три двугранных угла для последовательностей (2,3,4), (3,4,5) и (4,5,6). Следующая связь, от атома 6, также ориентирована под двугранным углом, поэтому мы имеем четыре степени свободы . Но эта последняя связь должна заканчиваться в положении атома 1, что накладывает три условия в трехмерном пространстве. Если валентный угол в цепочке (6,1,2) также должен быть тетраэдрическим углом, то имеем четыре условия. В принципе это означает, что не существует степеней свободы конформации, если предположить, что все длины связей равны и все углы между связями равны. Оказывается, что при фиксированных атомах 1, 2 и 3 существует два решения, называемых стулом , в зависимости от того, является ли двугранный угол для (1,2,3,4) положительным или отрицательным, и эти два решения одинаковы. под ротацию. Но существует также континуум решений, топологический круг , в котором угловая деформация равна нулю, включая конформации «твист-лодочки» и «лодочки» . Все конформации в этом континууме имеют двойную ось симметрии, проходящую через кольцо, тогда как конформации стула ее не имеют (они обладают симметрией D 3d с тройной осью симметрии, проходящей через кольцо). Именно из-за симметрии конформаций в этом континууме можно удовлетворить всем четырем ограничениям с диапазоном двугранных углов (1,2,3,4). В этом континууме энергия меняется из-за деформации Питцера , связанной с двугранными углами. Лодка-твист имеет меньшую энергию, чем лодка. Чтобы перейти от конформации стула к конформации скрученной лодочки или к другой конформации стула, необходимо изменить валентные углы, что приводит к высокоэнергетической конформации полукресла . Таким образом, относительная устойчивость такова: стул > лодочка > лодка > полустул . Все относительные конформационные энергии показаны ниже. [3] [4] При комнатной температуре молекула может легко перемещаться между этими конформациями, но в чистом виде можно выделить только стул и твист-лодочку , поскольку остальные не находятся в локальных энергетических минимумах.
Конформации «лодочки» и «скрученной лодочки», как уже говорилось, лежат вдоль континуума деформации с нулевым углом. Если существуют заместители, которые позволяют различать разные атомы углерода, то этот континуум подобен кругу с шестью конформациями лодочки и шестью конформациями скрученной лодочки между ними: тремя «правыми» и тремя «левыми». (Какую следует называть правосторонней, неважно.) Но если атомы углерода неразличимы, как в самом циклогексане, то движение по континууму переводит молекулу из формы лодочки в «правостороннюю» лодочку-закручивание, а затем обратно к той же форме лодочки (с перестановкой атомов углерода), затем к «левой» твист-лодочке, а затем снова к ахиральной лодочке. Переход лодка⊣твист-лодка⊣лодка⊣твист-лодка⊣лодка представляет собой псевдовращение .
Другой способ сравнить стабильность двух молекул циклогексана в одной и той же конформации — оценить количество копланарных атомов углерода в каждой молекуле. [4] Компланарные углероды — это углероды, находящиеся в одной плоскости. Увеличение числа копланарных атомов углерода увеличивает число затмевающих заместителей, пытающихся образовать 120°, что недостижимо из-за перекрывающихся атомов водорода. [5] Это перекрытие увеличивает общую деформацию кручения и снижает стабильность конформации. Циклогексан уменьшает деформацию кручения из-за затмевающих заместителей за счет принятия конформации с меньшим количеством неплоских атомов углерода. [6] Например, если конформация полукресла содержит четыре копланарных атома углерода, а другая конформация полукресла содержит пять копланарных атомов углерода, конформация с четырьмя копланарными атомами углерода будет более стабильной. [4]
Различные конформации называются «конформерами» - смесь слов «конформация» и «изомер».
Конформация стула является наиболее устойчивым конформером. При 298 К (25 °С) 99,99% всех молекул в растворе циклогексана принимают эту конформацию.
Группа симметрии — D3d . _ Все углеродные центры эквивалентны. Шесть водородных центров расположены в аксиальных положениях, примерно параллельных оси C3, а шесть атомов водорода параллельны экватору молекулы.
Каждый углерод несет один «верхний» и один «нижний» водород. Таким образом, связи C–H в последовательных атомах углерода расположены в шахматном порядке , поэтому деформация кручения незначительна . Геометрия стула часто сохраняется при замене атомов водорода галогенами или другими простыми группами . Однако когда эти атомы водорода заменяются на более крупную группу, на молекулу оказывается напряжение из-за двухосных взаимодействий. Это взаимодействие (обычно отталкивающее) между двумя заместителями в аксиальном положении циклогексанового кольца. [7]
Если представить атом углерода как точку с четырьмя полусвязями, направленными к вершинам тетраэдра , можно представить его стоящим на поверхности с одной полусвязью, направленной прямо вверх. Если смотреть сверху, кажется, что остальные три направлены наружу к вершинам равностороннего треугольника , поэтому кажется, что связи между ними имеют угол 120°. Теперь рассмотрим шесть таких атомов, стоящих на поверхности так, что их невертикальные полусвязи встречаются и образуют идеальный шестиугольник. Если затем три атома отразятся и окажутся ниже поверхности, результат будет очень похож на циклогексан в конформации стула. В этой модели шесть вертикальных полусвязей расположены точно вертикально, а торчащие из кольца концы шести невертикальных полусвязей находятся точно на экваторе (то есть на поверхности). Поскольку связи C–H на самом деле длиннее, чем половина связи C–C, «экваториальные» атомы водорода циклогексана-председателя фактически будут находиться ниже экватора, когда они присоединены к углероду, который находится над экватором, и наоборот. Это справедливо и для других заместителей. Двугранный угол для серии из четырех атомов углерода, вращающихся вокруг кольца, в этой модели чередуется ровно между +60 ° и -60 ° (так называемый « гош »).
Конформация стула не может деформироваться без изменения углов соединения или длины. Мы можем думать о нем как о двух цепочках, зеркальных отражениях одна другой, содержащих атомы (1,2,3,4) и (1,6,5,4) с противоположными двугранными углами. Расстояние от атома 1 до атома 4 зависит от абсолютной величины двугранного угла. Если эти два двугранных угла изменяются (по-прежнему оставаясь противоположными друг другу), невозможно поддерживать правильный валентный угол как для углерода 1, так и для углерода 4.
Конформации лодочки имеют более высокую энергию, чем конформации кресла. В частности, взаимодействие между двумя водородами флагштока создает стерическое напряжение . Деформация кручения также существует между связями C2–C3 и C5–C6 (углеродный номер 1 является одним из двух в зеркальной плоскости), которые затмеваются , то есть эти две связи параллельны друг другу в зеркальной плоскости. Из-за этой деформации конфигурация лодки нестабильна (т.е. не имеет локального минимума энергии).
Молекулярная симметрия C 2v . _
Конформации лодочки спонтанно искажаются до конформации твист-лодочки. Здесь симметрия равна D 2 , чисто вращательной точечной группе с тремя осями двойного порядка. Эту конформацию можно получить из конформации лодочки, слегка повернув молекулу, чтобы устранить затмение двух пар метиленовых групп. Конформация твист-лодочки является хиральной и существует в правосторонней и левосторонней версиях.
Концентрация конформации «твист-лодочка» при комнатной температуре составляет менее 0,1%, но при 1073 К (800 °С) она может достигать 30%. Быстрое охлаждение образца циклогексана от 1073 К (800 ° C) до 40 К (-233 ° C) приведет к замерзанию большой концентрации конформации «твист-лодочки», которая затем при нагревании медленно преобразуется в конформацию стула. [8]
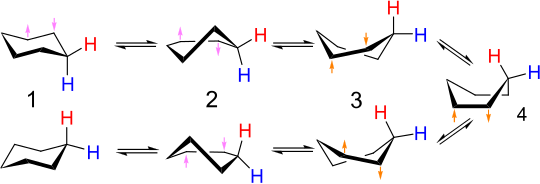
Взаимное превращение конформеров стула называется переворачиванием кольца или переворотом кресла . Углеродно-водородные связи, осевые в одной конфигурации, становятся экваториальными в другой, и наоборот. При комнатной температуре две конформации стула быстро уравновешиваются . Спектр ЯМР протонов циклогексана при комнатной температуре является синглетным, без разделения на отдельные сигналы аксиальных и экваториальных атомов водорода.
В одной форме стула двугранный угол цепочки атомов углерода (1,2,3,4) положителен, тогда как угол цепочки (1,6,5,4) отрицателен, но в другой форме стула ситуация обратная. Таким образом, обе эти цепи должны претерпеть изменение двугранного угла. Когда одна из этих двух четырехатомных цепочек сплющивается до нулевого двугранного угла, мы имеем конформацию полукресла с максимальной энергией на пути конверсии. Когда двугранный угол этой цепи становится равным (как по знаку, так и по величине) углу другой четырехатомной цепи, молекула достигает континуума конформаций, включая твист-лодочку и лодочку, где валентные углы и все длины могут иметь свои нормальные значения, и поэтому энергия относительно невелика. После этого другая четырехуглеродная цепь должна сменить знак своего двугранного угла, чтобы достичь целевой формы кресла, поэтому молекула снова должна пройти через полукресло, поскольку двугранный угол этой цепи проходит через ноль. Последовательное переключение знаков двух цепочек таким образом минимизирует максимальное энергетическое состояние на этом пути (в состоянии полукресла) - если двугранные углы обеих четырехатомных цепочек одновременно меняют знак, это означало бы пройти через конформацию еще более высокой энергия из-за угловой деформации атомов углерода 1 и 4.
Подробный механизм взаимного преобразования стула в стул был предметом многочисленных исследований и дискуссий. [9] Состояние полукресла ( D , на рисунке ниже) является ключевым переходным состоянием во взаимном преобразовании между конформациями кресла и твист-лодочки. Полукресло имеет симметрию С 2 . Взаимное преобразование двух конформаций стула включает следующую последовательность: стул → полукресло → твист-лодочка → полукресло → стул.
Конформация лодочки ( C , ниже) представляет собой переходное состояние, позволяющее взаимное преобразование между двумя различными конформациями лодочки. Хотя конформация лодочки не является необходимой для взаимного превращения двух конформаций стула циклогексана, ее часто включают в диаграмму координат реакции , используемую для описания этого взаимного превращения, поскольку ее энергия значительно ниже, чем у полукресла, поэтому любая молекула с достаточным количеством энергии, чтобы перейти от поворотной лодки к стулу, также достаточно энергии, чтобы перейти от поворотной лодки к лодке. Таким образом, существует множество путей, с помощью которых молекула циклогексана в конформации твист-лодочки может снова достичь конформации кресла.


В циклогексане две конформации стула имеют одинаковую энергию. Ситуация усложняется с замещенными производными.
Монозамещенный циклогексан – это циклогексан, в циклогексановом кольце которого имеется один неводородный заместитель. Наиболее энергетически выгодной конформацией монозамещенного циклогексана является конформация кресла с неводородным заместителем в экваториальном положении, поскольку она предотвращает высокую стерическую деформацию от 1,3-диаксиальных взаимодействий. [10] В метилциклогексане два конформера кресла не изоэнергетические. Метильная группа предпочитает экваториальную ориентацию. Предпочтение заместителя по отношению к экваториальной конформации измеряется его значением A , которое представляет собой разность свободной энергии Гиббса между двумя конформациями стула. Положительное значение A указывает на предпочтение экваториального положения. Величина значений A колеблется от почти нуля для очень маленьких заместителей, таких как дейтерий, до примерно 5 ккал/моль (21 кДж/моль) для очень объемных заместителей, таких как трет-бутильная группа. Таким образом, величина значения А также будет соответствовать предпочтению экваториального положения. Хотя экваториальный заместитель не имеет 1,3-диаксиального взаимодействия, вызывающего стерическую деформацию, он имеет взаимодействие Гоша, при котором экваториальный заместитель отталкивает электронную плотность от соседнего экваториального заместителя. [10]
Для 1,2- и 1,4-дизамещенных циклогексанов цис- конфигурация приводит к образованию одной аксиальной и одной экваториальной группы. У таких видов наблюдается быстрое и дегенеративное переворачивание стула. Для 1,2- и 1,4-дизамещенного циклогексана ( транс- конфигурация) двухосная конформация эффективно предотвращается из-за его высокой стерической деформации. Для 1,3-дизамещенных циклогексанов цис- форма является диэкваториальной, а перевернутая конформация испытывает дополнительное стерическое взаимодействие между двумя аксиальными группами. транс -1,3-дизамещенные циклогексаны подобны цис -1,2- и цис -1,4- и могут переключаться между двумя эквивалентными аксиальными/экваториальными формами. [2]
Цис -1,4-ди- трет -бутилциклогексан имеет аксиальную трет -бутильную группу в конформации «кресло», а преобразование в конформацию «твист-лодочки» помещает обе группы в более выгодные экваториальные положения. В результате конформация «твист-лодочка» становится более стабильной на 0,47 кДж/моль (0,11 ккал/моль) при 125 К (-148 ° C), как измерено методом ЯМР-спектроскопии . [9]
Кроме того, для дизамещенного циклогексана, а также для более сильнозамещенных молекул вышеупомянутые значения A являются аддитивными для каждого заместителя. Например, при расчете значения А диметилциклогексана вклад любой метильной группы в аксиальном положении составляет 1,70 ккал/моль — это число специфично для метильных групп и различно для каждого возможного заместителя. Следовательно, общее значение A для молекулы составляет 1,70 ккал/моль на метильную группу в аксиальном положении. [11]
1,3 Диаксиальные взаимодействия возникают, когда неводородный заместитель в циклогексане занимает аксиальное положение. Этот аксиальный заместитель находится в затменном положении относительно аксиальных заместителей на 3-углероде относительно него самого (будет два таких углерода и, следовательно, два 1,3-диаксиальных взаимодействия). Это затменное положение увеличивает стерическую нагрузку на конформацию циклогексана, и подтверждение сместится в сторону более энергетически выгодного равновесия. [12]
Гош-взаимодействия возникают, когда неводородный заместитель в циклогексане занимает экваториальное положение. Экваториальный заместитель находится в шахматном положении с 2-углеродами относительно самого себя (будет два таких углерода и, следовательно, два 1,2-гош-взаимодействия). Это создает двугранный угол ~ 60 °. [13] Это шахматное положение обычно предпочтительнее скрытого.
Опять же, конформация и положение групп (т.е. заместителей), больших, чем один водород, имеют решающее значение для общей стабильности молекулы. Чем больше группа, тем менее вероятно, что они предпочтут аксиальное положение соответствующего углерода. Поддержание указанного положения при большем размере требует больше энергии от молекулы в целом из-за стерического отталкивания между несвязанными электронными парами больших групп и электронами меньших групп (т.е. водородами). Такие стерические отталкивания отсутствуют для экваториальных групп. Таким образом, модель циклогексана оценивает стерический размер функциональных групп на основе гош-взаимодействий. [14] Энергия гош-взаимодействия будет возрастать по мере увеличения размера участвующего заместителя. Например, трет-бутильный заместитель будет поддерживать более высокоэнергетическое взаимодействие по сравнению с метильной группой и, следовательно, вносить больший вклад в нестабильность молекулы в целом.
По сравнению с этим, шахматная конформация является предпочтительной; более крупные группы будут сохранять экваториальное положение и снижать энергию всей молекулы. Это предпочтение экваториального положения среди более объемных групп снижает энергетические барьеры между различными конформациями кольца. Когда молекула активируется, произойдет потеря энтропии из-за стабильности более крупных заместителей. Следовательно, предпочтение крупных молекул (таких как метильная группа) экваториальных положений ингибирует реакционную способность молекулы и, таким образом, делает молекулу более стабильной в целом. [15]
Конформационное равновесие — это тенденция отдавать предпочтение конформации, в которой циклогексан является наиболее стабильным. Это равновесие зависит от взаимодействия между молекулами соединения и растворителя. Полярность и неполярность являются основными факторами, определяющими, насколько хорошо растворитель взаимодействует с соединением. Циклогексан считается неполярным, что означает, что между его связями нет электроотрицательной разницы, а его общая структура симметрична. В связи с этим, когда циклогексан погружен в полярный растворитель, он будет иметь меньшее распределение растворителя, что означает плохое взаимодействие между растворителем и растворенным веществом. Это дает ограниченный каталитический эффект. [16] Более того, когда циклогексан вступает в контакт с неполярным растворителем, распределение растворителя намного больше, что свидетельствует о сильном взаимодействии между растворителем и растворенным веществом. Это сильное взаимодействие приводит к усилению каталитического эффекта.
Гетероциклические аналоги циклогексана широко распространены в сахарах, пиперидинах, диоксанах и т. д. Их существование обычно соответствует тенденциям, наблюдаемым для циклогексана, т.е. конформер кресла является наиболее стабильным. Однако на аксиально-экваториальное равновесие (значения A) сильно влияет замена метилена на O или NH. Показательны конформации глюкозидов . [2] 1,2,4,5-Тетратиан ((SCH 2 ) 3 ) лишен неблагоприятных 1,3-диаксиальных взаимодействий циклогексана. Следовательно, его форма твист-лодочки заселена; в соответствующей тетраметильной структуре 3,3,6,6-тетраметил-1,2,4,5-тетратиана доминирует конформация «твист-лодочка».
В 1890 году Герман Закс , 28-летний ассистент из Берлина, опубликовал инструкции по складыванию листа бумаги, изображающему две формы циклогексана, которые он назвал симметричной и асимметричной (то, что мы сейчас назвали бы стулом и лодкой ). Он ясно понимал, что эти формы имеют два положения для атомов водорода (опять же, если использовать современную терминологию, аксиальное и экваториальное ), что два стула, вероятно, будут взаимопревращаться, и даже то, что определенные заместители могут благоприятствовать одной из форм стула (теория Саксе-Мора). ). Поскольку он выразил все это математическим языком, немногие химики того времени поняли его аргументы. У него было несколько попыток опубликовать эти идеи, но ни одной из них не удалось захватить воображение химиков. Его смерть в 1893 году в возрасте 31 года означала, что его идеи канули в безвестность. И только в 1918 году Эрнст Мор на основе молекулярной структуры алмаза, которая недавно была решена с помощью совершенно новой на тот момент техники рентгеновской кристаллографии , [17] [18] смог успешно доказать, что кресло Саксе был основным мотивом. [19] [20] [21] [22] [23] [24] Дерек Бартон и Одд Хассел получили Нобелевскую премию по химии 1969 года за работу над конформациями циклогексана и различных других молекул.
Циклогексан является наиболее стабильным из циклоалканов из-за устойчивости адаптации к своему конформеру кресла. [4] Такая стабильность конформера позволяет использовать циклогексан в качестве стандарта в лабораторных анализах. Более конкретно, циклогексан используется в качестве фармацевтического эталона при анализе растворителей фармацевтических соединений и сырья. Этот конкретный стандарт означает, что циклогексан используется при анализе качества пищевых продуктов и напитков, тестировании выпуска фармацевтических препаратов и разработке фармацевтических методов; [25] эти различные методы проверяют чистоту, биобезопасность и биодоступность продуктов. [26] Стабильность конформера стула циклогексана дает циклоалкану универсальное и важное применение с точки зрения безопасности и свойств фармацевтических препаратов.
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )