
Реакция элиминирования E1cB — это тип реакции элиминирования , которая происходит в основных условиях, где удаляемый водород является относительно кислым, в то время как уходящая группа (например, -OH или -OR) является относительно слабой. Обычно присутствует основание от умеренного до сильного. E1cB — это двухэтапный процесс, первый этап которого может быть обратимым или нет. Сначала основание отщепляет относительно кислый протон, образуя стабилизированный анион . Затем неподеленная пара электронов на анионе перемещается к соседнему атому, таким образом вытесняя уходящую группу и образуя двойную или тройную связь . [1] Название механизма — E1cB — означает Elimination Unimolecular conjugate Base ( Элиминирование Унимолекулярных сопряженных оснований) . Элиминирование относится к тому факту, что механизм является реакцией элиминирования и будет терять два заместителя. Унимолекулярный относится к тому факту, что определяющий скорость этап этой реакции включает только одну молекулярную сущность . Наконец, сопряженное основание относится к образованию промежуточного карбаниона , который является сопряженным основанием исходного материала.
E1cB следует рассматривать как находящийся на одном конце непрерывного спектра, который включает механизм E1 на противоположном конце и механизм E2 в середине. Механизм E1 обычно имеет противоположные характеристики: уходящая группа является хорошей (например, -OTs или -Br), в то время как водород не является особенно кислотным, а сильное основание отсутствует. Таким образом, в механизме E1 уходящая группа уходит первой, образуя карбокатион. Из-за наличия пустой p-орбитали после ухода уходящей группы водород на соседнем углероде становится намного более кислым, что позволяет затем удалить его слабым основанием на втором этапе. В реакции E2 наличие сильного основания и хорошей уходящей группы позволяет отрыву протона основанием и уходу уходящей группы происходить одновременно, что приводит к согласованному переходному состоянию в одностадийном процессе.

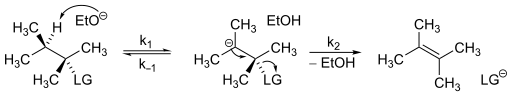
Для протекания реакции по механистическому пути E1cB необходимо два основных требования. Соединение должно иметь кислотный водород на своем β-углероде и относительно слабую уходящую группу на α-углероде . Первым шагом механизма E1cB является депротонирование β-углерода, что приводит к образованию анионного переходного состояния, такого как карбанион. Чем выше стабильность этого переходного состояния, тем больше механизм будет благоприятствовать механизму E1cB. Это переходное состояние может быть стабилизировано посредством индукции или делокализации неподеленной электронной пары посредством резонанса . В целом можно утверждать, что электроноакцепторная группа на субстрате, сильное основание, слабая уходящая группа и полярный растворитель запускают механизм E1cB. Пример механизма E1cB, который имеет стабильное переходное состояние, можно увидеть в деградации этиофенкарба — инсектицида на основе карбамата , который имеет относительно короткий период полураспада в атмосфере Земли. При депротонировании амина полученный амид относительно стабилен, поскольку он сопряжен с соседним карбонилом . В дополнение к содержанию кислотного водорода на β-углероде также необходима относительно плохая уходящая группа. Плохая уходящая группа необходима, поскольку хорошая уходящая группа уйдет до ионизации молекулы. В результате соединение, вероятно, будет проходить по пути E2 . Некоторые примеры соединений, которые содержат плохие уходящие группы и могут подвергаться механизму E1cB, — это спирты и фторалканы . Также было высказано предположение, что механизм E1cB более распространен среди алкенов, отщепляющихся до алкинов , чем от алкана до алкена. [2] Одним из возможных объяснений этого является то, что гибридизация sp 2 создает немного больше кислотных протонов. Хотя этот механизм не ограничивается отщеплениями на основе углерода . Он наблюдался и с другими гетероатомами , такими как азот при отщеплении производного фенола от этиофенкарба . [3]

Все реакции элиминирования включают удаление двух заместителей из пары атомов в соединении. Образуются алкены, алкины или подобные гетероатомные вариации (такие как карбонил и циано ). Механизм E1cB — это всего лишь один из трех типов реакции элиминирования. Другие две реакции элиминирования — это реакции E1 и E2. Хотя механизмы похожи, они различаются по времени депротонирования α-углерода и потери уходящей группы. E1 обозначает мономолекулярное элиминирование, а E2 обозначает бимолекулярное элиминирование. В механизме E1 молекула содержит хорошую уходящую группу, которая уходит до депротонирования α-углерода. Это приводит к образованию промежуточного карбокатиона. Затем карбокатион депротонируется, что приводит к образованию новой пи-связи. Участвующая молекула также должна иметь очень хорошую уходящую группу, такую как бром или хлор, и она должна иметь относительно менее кислый α-углерод.

В реакции элиминирования E2 и депротонирование α-углерода, и потеря уходящей группы происходят одновременно в одном согласованном шаге. Молекулы, которые подвергаются механизмам элиминирования E2, имеют более кислые α-углероды, чем те, которые подвергаются механизмам E1, но их α-углероды не такие кислые, как у молекул, которые подвергаются механизмам E1cB. Ключевое различие между путями E2 и E1cb заключается в отдельном промежуточном карбанионе , а не в одном согласованном механизме. Исследования показали, что пути отличаются использованием разных уходящих групп галогена . В одном примере хлор используется как лучший стабилизирующий галоген для аниона , чем фтор , [4] , что делает фтор уходящей группой, хотя хлор является гораздо лучшей уходящей группой. [5] Это свидетельствует о том, что карбанион образуется, потому что продукты невозможны через наиболее стабильный согласованный механизм E2 . В следующей таблице суммированы ключевые различия между тремя реакциями элиминирования; Однако лучший способ определить, какой механизм играет ключевую роль в конкретной реакции, — это применение химической кинетики .
При попытке определить, следует ли реакция механизму E1cB, химическая кинетика имеет важное значение. Лучший способ определить механизм E1cB включает использование законов скорости и кинетического изотопного эффекта . Эти методы также могут помочь в дальнейшем дифференциации реакций элиминирования E1cB, E1 и E2.
При попытке экспериментально определить, следует ли реакция механизму E1cB, химическая кинетика имеет важное значение. Лучшие способы определения механизма E1cB включают использование законов скорости и кинетического изотопного эффекта.
Закон скорости, который управляет механизмами E1cB, относительно прост для определения. Рассмотрим следующую схему реакции.
Предполагая, что в механизме существует стационарная концентрация карбанионов, закон скорости для механизма E1cB.
Из этого уравнения ясно, что будет проявляться кинетика второго порядка . [6] Кинетика механизмов E1cB может немного различаться в зависимости от скорости каждого шага. В результате механизм E1cB можно разбить на три категории: [7]
Обмен дейтерия и кинетический изотопный эффект дейтерия могут помочь различить E1cB rev , E1cB anion и E1cB irr . Если растворитель протонный и содержит дейтерий вместо водорода (например, CH 3 OD), то можно отслеживать обмен протонами в исходном материале. Если извлеченный исходный материал содержит дейтерий, то реакция, скорее всего, проходит по механизму типа E1cB rev . Напомним, в этом механизме протонирование карбаниона (либо сопряженной кислотой, либо растворителем) происходит быстрее, чем потеря уходящей группы. Это означает, что после образования карбаниона он быстро удалит протон из растворителя, образуя исходный материал.
Если реагент содержит дейтерий в β-положении, первичный кинетический изотопный эффект указывает на то, что депротонирование является определяющим скорость. Из трех механизмов E1cB этот результат согласуется только с механизмом E1cB irr , поскольку изотоп уже удален в анионе E1cB , а отход уходящей группы является определяющим фактором скорости в E1cB rev .
Другой способ, которым кинетический изотопный эффект может помочь различить механизмы E1cB, включает использование 19 F. Фтор является относительно плохой уходящей группой, и он часто используется в механизмах E1cB. Кинетические изотопные эффекты фтора также применяются при маркировке радиофармацевтических препаратов и других соединений в медицинских исследованиях. Этот эксперимент очень полезен для определения того, является ли потеря уходящей группы определяющим скорость этапом в механизме, и может помочь различить механизмы E1cB irr и E2. 11 C также может быть использован для исследования природы структуры переходного состояния. Использование 11 C может быть использовано для изучения образования карбаниона, а также для изучения его времени жизни, что может не только показать, что реакция представляет собой двухэтапный механизм E1cB (в отличие от согласованного механизма E2), но также может рассмотреть время жизни и стабильность структуры переходного состояния, что может дополнительно различить три различных типа механизмов E1cB. [8]
Наиболее известная реакция, в которой происходит элиминирование E1cB, — это реакция альдольной конденсации в основных условиях. Она включает депротонирование соединения, содержащего карбонильную группу, что приводит к образованию енолята . Енолят — это очень стабильное сопряженное основание исходного материала, и является одним из промежуточных продуктов в реакции. Затем этот енолят действует как нуклеофил и может атаковать электрофильный альдегид. Затем продукт альдольной реакции депротонируется, образуя другой енолят, за которым следует элиминирование воды в реакции дегидратации E1cB . Альдольные реакции являются ключевой реакцией в органической химии, поскольку они обеспечивают средства для образования углерод-углеродных связей, что позволяет синтезировать более сложные молекулы. [9]

Фотохимическая версия E1cB была описана Люкманом и др. [10] В этом отчете фотохимически индуцированная реакция декарбоксилирования генерирует промежуточный карбанион, который впоследствии устраняет уходящую группу. Реакция уникальна среди других форм E1cB, поскольку для генерации карбаниона не требуется основания. Стадия образования карбаниона необратима и, таким образом, должна быть классифицирована как E1cB irr .

Реакция элиминирования E1cB является важной реакцией в биологии. Например, предпоследний этап гликолиза включает механизм E1cB. Этот этап включает преобразование 2-фосфоглицерата в фосфоенолпируват , которое осуществляется ферментом енолазой .