Химическое уравнение — это символическое представление химической реакции в виде символов и химических формул . Реагенты указаны слева, а продукты — справа, со знаком плюс между объектами как в реагентах, так и в продуктах, а также стрелкой, указывающей на продукты, чтобы указать направление движения . Реакция. [1] Химические формулы могут быть символическими, структурными (иллюстрированные диаграммы) или смешанными. Коэффициенты рядом с символами и формулами сущностей представляют собой абсолютные значения стехиометрических чисел . Первое химическое уравнение было построено Жаном Бегеном в 1615 году. [2]
Химическое уравнение (см. пример ниже) состоит из списка реагентов (исходных веществ) в левой части, символа стрелки и списка продуктов (веществ, образующихся в химической реакции) в правой части. . Каждое вещество определяется своей химической формулой , которой может предшествовать число, называемое стехиометрическим коэффициентом . [a] Коэффициент указывает, сколько объектов (например, молекул ) этого вещества участвует в реакции на молекулярной основе. Если не написано явно, коэффициент равен 1. Несколько веществ в любой части уравнения отделяются друг от друга знаком плюс .
В качестве примера можно обозначить уравнение реакции соляной кислоты с натрием :
Учитывая, что формулы довольно просты, это уравнение можно прочитать как «два HCL плюс два NA дают [b] два NACL и два H». С другой стороны, как правило, для уравнений, включающих сложные химические вещества, химические формулы читаются с использованием номенклатуры ИЮПАК , которая может выразить это уравнение так: «две молекулы соляной кислоты и два атома натрия реагируют с образованием двух формульных единиц хлорида натрия и молекулы газообразного водорода. "
Для обозначения типа реакции используются разные варианты символа стрелки: [1]
Чтобы указать физическое состояние химического вещества, к его формуле можно добавить символ в скобках: (s) для твердого тела, (l) для жидкости, (g) для газа и (водный раствор) для водного раствора . Это особенно делается, когда кто-то хочет подчеркнуть состояния или их изменения. Например, реакция водного раствора соляной кислоты с твердым (металлическим) натрием с образованием водного раствора хлорида натрия и газообразного водорода будет записываться так:
Эта реакция имела бы другие термодинамические и кинетические свойства, если бы газообразный хлористый водород заменил соляную кислоту в качестве реагента:
Альтернативно, стрелка без скобок в некоторых случаях используется для обозначения образования газа ↑ или осадка ↓. Это особенно полезно, если образуется только один такой вид. Вот пример, показывающий, что образуется газообразный водород:
Если реакция требует энергии, это указано над стрелкой. На стрелке реакции ставится заглавная греческая буква дельта (Δ) или треугольник (△) [е] , чтобы показать, что к реакции присоединяется энергия в виде тепла. Выражение hν [f] используется как символ добавления энергии в форме света. Другие символы используются для других конкретных типов энергии или излучения.
Аналогично, если для реакции требуется определенная среда с определенными характеристиками, то над стрелкой можно поместить название кислоты или основания, которое используется в качестве среды. Если конкретная кислота или основание не требуется, другой способ обозначить использование кислой или основной среды - написать H + или OH - (или даже «кислота» или «основание») вверху стрелки. Таким же образом могут быть указаны конкретные условия температуры и давления, а также наличие катализаторов.

Стандартные обозначения химических уравнений допускают только все реагенты с одной стороны, все продукты с другой и все стехиометрические коэффициенты положительные. Например, обычная форма уравнения дегидратации метанола в диметиловый эфир :
Иногда используется расширение, в котором некоторые вещества с их стехиометрическими коэффициентами перемещаются выше или ниже стрелки, которым предшествует знак плюс или ничего для реагента и знак минус для продукта. Тогда то же уравнение может выглядеть так:
Такие обозначения служат для того, чтобы скрыть менее важные вещества от сторон уравнения, сделать тип рассматриваемой реакции более очевидным и облегчить составление цепочек химических уравнений. Это очень полезно для иллюстрации механизмов многоступенчатых реакций . Обратите внимание, что вещества, расположенные выше или ниже стрелок, в данном случае не являются катализаторами , поскольку они расходуются или производятся в реакции, как обычные реагенты или продукты.
Другое расширение, используемое в механизмах реакций, перемещает некоторые вещества к ветвям стрелки. Оба расширения используются в примере иллюстрации механизма.
Использование отрицательных стехиометрических коэффициентов по обе стороны уравнения (как в примере ниже) не получило широкого распространения и часто не рекомендуется. [5] [ нужен лучший источник ]
Поскольку в химической реакции не происходит ядерных реакций , химические элементы проходят реакцию в неизмененном виде. Таким образом, каждая часть химического уравнения должна представлять одинаковое количество атомов любого конкретного элемента (или нуклида , если учитывать разные изотопы ). То же самое справедливо и для полного электрического заряда , как утверждает закон сохранения заряда . Уравнение, удовлетворяющее этим требованиям, называется сбалансированным .
Химическое уравнение балансируется путем присвоения подходящих значений стехиометрическим коэффициентам. Простые уравнения можно сбалансировать путем проверки, то есть методом проб и ошибок. Другой метод предполагает решение системы линейных уравнений .
Сбалансированные уравнения обычно записываются с наименьшими натуральными коэффициентами. Однако иногда может оказаться выгодным принять дробный коэффициент, если он упростит другие коэффициенты. Таким образом, вводный пример можно переписать как
В некоторых случаях дробные коэффициенты даже неизбежны. Например, реакцию, соответствующую стандартной энтальпии образования, нужно записать так, чтобы образовалась одна молекула одного продукта. Это часто требует, чтобы некоторые коэффициенты реагентов были дробными, как в случае с образованием фторида лития :

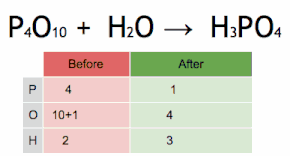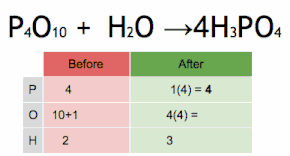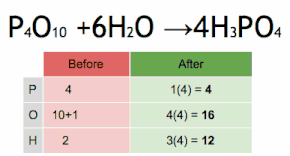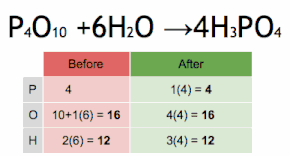
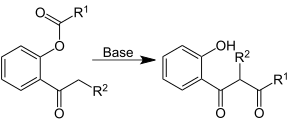
Метод проверки можно описать как установку стехиометрического коэффициента самого сложного вещества на 1 и пошаговое присвоение значений другим коэффициентам так, чтобы обе части уравнения в конечном итоге содержали одинаковое количество атомов для каждого элемента. Если в ходе этого процесса возникают какие-либо дробные коэффициенты, то наличие дробей можно исключить (в любой момент) умножением всех коэффициентов на их наименьший общий знаменатель .
Балансировка химического уравнения полного сгорания метана
достигается следующим образом:
Для каждого химического элемента (или нуклида, или неизмененного фрагмента или заряда) i требование его сохранения может быть выражено математическим уравнением
где
В результате получается однородная система линейных уравнений , которые легко решаются математическими методами. Такая система всегда имеет тривиальное решение , состоящее из всех нулей , которое нас не интересует, но если и существуют дополнительные решения, то их будет бесконечное количество. Любое нетривиальное решение уравновесит химическое уравнение. «Предпочтительным» решением является решение с целочисленными , преимущественно положительными [g] стехиометрическими коэффициентами s j с наибольшим общим делителем, равным единице.
Присвоим переменные стехиометрическим коэффициентам химического уравнения из предыдущего раздела и запишем соответствующие линейные уравнения:
Все решения этой системы линейных уравнений имеют следующий вид, где r – любое действительное число :
Выбор r = 1 дает предпочтительное решение:
что соответствует сбалансированному химическому уравнению:
Система линейных уравнений, представленная в предыдущем разделе, также может быть записана с использованием эффективного матричного формализма. Сначала для унификации стехиометрических коэффициентов реагента и продукта s j введем величину
называется стехиометрическим числом , [h] , которое упрощает линейные уравнения до
где J – общее количество реагирующих и продуктовых веществ (формул) в химическом уравнении.
Размещение значений a ij в строке i и столбце j матрицы композиции
и расположение стехиометрических чисел в стехиометрический вектор
позволяет выразить систему уравнений в виде одного матричного уравнения :
Как и ранее, любой ненулевой стехиометрический вектор ν , который решает матричное уравнение, уравновешивает химическое уравнение.
Множество решений матричного уравнения представляет собой линейное пространство , называемое ядром матрицы A. Чтобы это пространство содержало ненулевые векторы ν , т. е. имело положительную размерность J N , столбцы матрицы композиции A не должны быть линейно независимыми . Тогда проблема балансировки химического уравнения становится проблемой определения J N -мерного ядра матрицы состава. Важно отметить, что только для J N = 1 будет существовать единственное предпочтительное решение задачи балансировки. При J N > 1 будет бесконечное число предпочтительных решений, причем J N из них линейно независимы. Если J N = 0, останется только непригодное тривиальное решение — нулевой вектор.
Были разработаны методы [6] [7] для быстрого расчета набора J N независимых решений задачи балансировки, которые превосходят инспекционный и алгебраический метод [ нужна ссылка ] тем, что они являются определяющими и дают все решения балансировки. проблема.
Снова используя то же химическое уравнение, запишите соответствующее матричное уравнение:
Его решения имеют следующий вид, где r — любое действительное число:
Выбор r = 1 и смена знака первых двух строк дает предпочтительное решение проблемы балансировки:
Ионное уравнение — это химическое уравнение, в котором электролиты записаны в виде диссоциированных ионов . Ионные уравнения используются для реакций одинарного и двойного замещения , протекающих в водных растворах .
Например, в следующей реакции осаждения:
полное ионное уравнение:
или, включая все физические состояния:
В этой реакции ионы Ca 2+ и NO 3 - остаются в растворе и не участвуют в реакции. То есть эти ионы идентичны как со стороны реагента, так и со стороны продукта химического уравнения. Поскольку такие ионы не участвуют в реакции, их называют ионами-зрителями . Чистое ионное уравнение — это полное ионное уравнение, из которого удалены ионы-спектаторы. [8] Итоговое ионное уравнение протекающих реакций:
или, в уменьшенной сбалансированной форме,
В реакции нейтрализации или кислотно - основной реакции чистое ионное уравнение обычно будет иметь вид:
Есть несколько кислотно-основных реакций, в которых помимо молекулы воды, показанной выше, образуется осадок. Примером может служить реакция гидроксида бария с фосфорной кислотой , в результате которой образуется не только вода, но и нерастворимая соль фосфат бария. В этой реакции нет ионов-спектаторов, поэтому чистое ионное уравнение такое же, как и полное ионное уравнение.
Реакции двойного замещения, в которых карбонат реагирует с кислотой, имеют чистое ионное уравнение:
Если каждый ион является «ионом-наблюдателем», то реакции не было, и итоговое ионное уравнение равно нулю.
Обычно, если z j кратно элементарному заряду j -й молекулы, нейтральность заряда можно записать как:
где ν j — стехиометрические коэффициенты, описанные выше. Z j может быть включен [6] [7] в качестве дополнительной строки в матрицу a ij, описанную выше, и тогда правильно сбалансированное ионное уравнение также будет подчиняться :
Теперь г-н Пфаундлер объединил эти два явления в единую концепцию, рассматривая наблюдаемый предел как результат двух противоположных реакций, приводящих ту, что в приведенном примере, к образованию морской соли [т.е. NaCl] и азотной кислоты, [и ] другой к соляной кислоте и нитрату натрия. Это соображение, подтвержденное экспериментом, оправдывает выражение «химическое равновесие», которое используется для характеристики конечного состояния ограниченных реакций. Я бы предложил перевести это выражение следующим символом:
- HCl + NO 3 Na ⇄ NO 3 H + Cl Na.
Поэтому в данном случае я заменяю знак = в химическом уравнении знаком ⇄, который на самом деле не просто выражает равенство, но показывает также направление реакции. Это ясно выражает то, что химическое действие происходит одновременно в двух противоположных направлениях.
Или г-н Пфаундлер — это relié ces deux phénomênes... s'accomplit en même temps dans deux sens opposiés.