
Трехмерная ( 3D ) биопечать — это использование методов, подобных 3D-печати, для объединения клеток , факторов роста , биочернил и биоматериалов для изготовления функциональных структур, которые традиционно использовались для приложений тканевой инженерии , но в последнее время наблюдается повышенный интерес к другим такие приложения, как биосенсорство и восстановление окружающей среды . [1] [2] [3] Как правило, 3D-биопечать использует послойный метод нанесения материалов, известных как биочернила, для создания тканеподобных структур, которые позже используются в различных областях медицины и тканевой инженерии. [4] [5] 3D-биопечать охватывает широкий спектр методов биопечати и биоматериалов. В настоящее время биопечать можно использовать для печати моделей тканей и органов, чтобы помочь в исследовании лекарств и потенциальных методов лечения. [6] Тем не менее, перевод биопечатных живых клеточных конструкций в клиническое применение сталкивается с рядом проблем из-за сложности и количества клеток, необходимых для создания функциональных органов. [7] Однако инновации простираются от биопечати внеклеточного матрикса до смешивания клеток с гидрогелями, наносимыми слой за слоем, для получения желаемой ткани. [8] Кроме того, 3D-биопечать начала включать в себя печать каркасов, которые можно использовать для регенерации суставов и связок. [9] Помимо этого, 3D-биопечать недавно стала использоваться в целях восстановления окружающей среды, включая изготовление функциональных биопленок , содержащих функциональные микроорганизмы, которые могут облегчить удаление загрязняющих веществ. [10]
3D-биопечать обычно состоит из трех этапов: предварительная биопечать, биопечать и постбиопечать. [11] [12]
Предварительная биопечать — это процесс создания модели, которую впоследствии создаст принтер, и выбора материалов, которые будут использоваться. Одним из первых шагов является получение биопсии органа для взятия образцов клеток. Распространенными технологиями, используемыми для биопечати, являются компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). Для послойной печати на изображениях выполняется томографическая реконструкция . Теперь 2D-изображения затем отправляются на принтер для печати. После создания изображения определенные ячейки изолируются и размножаются. [11] Эти клетки затем смешивают со специальным жидким материалом, который обеспечивает кислород и другие питательные вещества, поддерживающие их жизнь. Эта агрегация клеток не требует каркаса и необходима для размещения в трубчатоподобной ткани при слиянии для таких процессов, как экструзия. [13] : 165
На втором этапе жидкие смеси клеток, матрикса и питательных веществ, известные как биочернила, помещаются в картридж принтера и наносятся с использованием медицинских сканирований пациентов. [14] Когда напечатанная на биопринтере предткань переносится в инкубатор, эта клеточная предткань созревает в ткань.
3D-биопечать для изготовления биологических конструкций обычно включает в себя распределение клеток на биосовместимый каркас с использованием последовательного послойного подхода для создания тканеподобных трехмерных структур. [15] Было показано, что в искусственных органах, таких как печень и почки, изготовленных с помощью 3D-биопечати, отсутствуют важные элементы, влияющие на организм, такие как работающие кровеносные сосуды, канальцы для сбора мочи и рост миллиардов клеток, необходимых для этих органов. Без этих компонентов организм не сможет получить необходимые питательные вещества и кислород глубоко внутри себя. [15] Учитывая, что каждая ткань в организме естественным образом состоит из разных типов клеток, многие технологии печати этих клеток различаются по своей способности обеспечивать стабильность и жизнеспособность клеток во время производственного процесса. Некоторые из методов, которые используются для 3D-биопечати клеток, — это фотолитография , магнитная 3D-биопечать , стереолитография и прямая экструзия клеток. [13] : 196
Процесс постбиопечати необходим для создания стабильной структуры из биологического материала. Если этот процесс не поддерживается должным образом, механическая целостность и функциональность 3D-печатного объекта находятся под угрозой. [11] Для поддержания объекта необходимы как механические, так и химические воздействия. Эти стимуляции посылают клеткам сигналы для контроля ремоделирования и роста тканей. Кроме того, недавние разработки биореакторных технологий [16] позволили обеспечить быстрое созревание тканей, васкуляризацию тканей и способность выживать после трансплантации. [12]
Биореакторы работают либо путем обеспечения конвективного транспорта питательных веществ, создания условий микрогравитации, изменения давления, заставляющего раствор течь через клетки, либо путем добавления сжатия для динамической или статической нагрузки. Каждый тип биореактора идеально подходит для разных типов тканей, например, компрессионные биореакторы идеально подходят для хрящевой ткани. [13] : 198
Исследователи в этой области разработали подходы к производству живых органов с соответствующими биологическими и механическими свойствами. 3D-биопечать основана на трех основных подходах: биомимикрия, автономная самосборка и строительные блоки мини-тканей. [17]
Первый подход биопечати называется биомимикрией. Основная цель этого подхода — создание искусственных структур, идентичных естественной структуре, присутствующей в тканях и органах человеческого тела. Биомимикрия требует дублирования формы, каркаса и микроокружения органов и тканей. [18] Применение биомимикрии в биопечати предполагает создание как идентичных клеточных, так и внеклеточных частей органов. Чтобы этот подход был успешным, ткани должны быть воспроизведены в микромасштабе. Следовательно, необходимо понимать микроокружение, природу биологических сил в этом микроокружении, точную организацию функциональных и поддерживающих типов клеток, факторы растворимости и состав внеклеточного матрикса. [17]
Второй подход биопечати – автономная самосборка. Этот подход опирается на физический процесс развития эмбриональных органов в качестве модели для репликации интересующих тканей. [18] Когда клетки находятся на ранней стадии развития, они создают свой собственный строительный блок внеклеточного матрикса, правильную клеточную передачу сигналов, а также независимое расположение и формирование паттернов для обеспечения необходимых биологических функций и микроархитектуры. [17] Автономная самосборка требует конкретной информации о способах развития тканей и органов эмбриона. [18] Существует «безкаркасная» модель, в которой используются самособирающиеся сфероиды, которые подвергаются слиянию и расположению клеток, чтобы напоминать развивающиеся ткани. Автономная самосборка зависит от клетки как фундаментальной движущей силы гистогенеза, определяющей строительные блоки, структурные и функциональные свойства этих тканей. Это требует более глубокого понимания того, как развиваются механизмы эмбриональных тканей, а также микроокружения, в котором создаются биопечатные ткани. [17]
Третий подход биопечати представляет собой комбинацию подходов биомимикрии и самосборки, называемых мини-тканями. Органы и ткани состоят из очень маленьких функциональных компонентов. Подход «мини-ткань» объединяет эти маленькие кусочки в более крупную структуру. [18] [17]

Подобно обычным струйным принтерам, биопринтеры состоят из трех основных компонентов. Это используемое оборудование, тип биочернил и материал, на котором они печатаются (биоматериалы). [11] Биочернила — это материал, изготовленный из живых клеток, который ведет себя во многом как жидкость, что позволяет людям «печатать» его, чтобы создать желаемую форму. Чтобы сделать биочернила, ученые создают суспензию клеток, которую можно загрузить в картридж и вставить в специально разработанный принтер вместе с другим картриджем , содержащим гель , известный как биобумага». Основные типы принтеров, которые использовались. Это струйные, лазерные и экструзионные принтеры. Струйные принтеры в основном используются в биопечати для быстрой и крупномасштабной печати. Один тип струйных принтеров называется струйным принтером по требованию. , печатает материалы в точном количестве, сводя к минимуму затраты и отходы. [20] Принтеры, в которых используются лазеры, обеспечивают печать с высоким разрешением, однако эти принтеры часто стоят дорого. Экструзионные принтеры печатают ячейки слой за слоем, как и 3D-печать для создания 3D. Помимо клеток, экструзионные принтеры также могут использовать гидрогели, наполненные клетками [11] .
Печать на основе экструзии — очень распространенный метод в области 3D-печати, который влечет за собой экструзию или нагнетание непрерывного потока расплавленного твердого материала или вязкой жидкости через своего рода отверстие, часто сопло или шприц. [21] Когда дело доходит до биопечати на основе экструзии, существует четыре основных типа экструзии. Они бывают с пневматическим приводом, с поршневым приводом, с винтовым приводом и с эксцентриковым винтовым приводом (также известные как винтовые насосы). Каждый метод экструзии имеет свои преимущества и недостатки. Пневматическая экструзия использует сжатый воздух для пропускания жидких биочернил через осаждающий агент. Воздушные фильтры обычно используются для стерилизации воздуха перед его использованием, чтобы гарантировать, что воздух, проталкивающий биочернила, не загрязнен. [22] При экструзии с поршневым приводом используется поршень, соединенный с направляющим винтом. Линейное движение поршня выдавливает материал из сопла. При экструзии с винтовым приводом используется шнековый шнек, который экструдирует материал с помощью вращательного движения. [23] Устройства с винтовым приводом позволяют использовать материалы с более высокой вязкостью и обеспечивают больший объемный контроль. [21] Системы с эксцентриковым шнековым приводом позволяют гораздо более точно наносить материалы от низкой до высокой вязкости благодаря самоуплотняющимся камерам экструдера. [24] После печати многие материалы требуют этапа сшивания для достижения желаемых механических свойств конструкции, чего можно достичь, например, с помощью обработки химическими агентами или фотосшивателями.
Прямая экструзия является одним из наиболее распространенных методов биопечати на основе экструзии, при котором сила давления заставляет биочернила вытекать из сопла и непосредственно печатать каркас без необходимости литья. [25] Сами биочернила для этого подхода могут представлять собой смесь полимерных гидрогелей, материалов природного происхождения, таких как коллаген , и живых клеток, суспендированных в растворе. [25] Таким образом, каркасы можно культивировать после печати и без необходимости дальнейшей обработки для посева клеток. Некоторый акцент в использовании методов прямой печати основан на использовании узлов коаксиальных сопел или коаксиальной экструзии. Установка коаксиального сопла обеспечивает одновременную экструзию биочернил из нескольких материалов, что позволяет создавать многослойные каркасы за один этап экструзии. [26] Разработка трубчатых структур показала, что послойная экструзия, достигаемая с помощью этих методов, желательна из-за радиальной изменчивости характеристик материала, которую она может предложить, поскольку коаксиальное сопло обеспечивает внутреннюю и внешнюю трубку для потока биочернил. [26] Методы непрямой экструзии для биопечати скорее требуют печати основного материала из насыщенных клетками гидрогелей, но в отличие от прямой экструзии он содержит жертвенный гидрогель, который можно легко удалить после печати посредством термической или химической экстракции. [27] Оставшаяся смола затвердевает и становится желаемой конструкцией, напечатанной на 3D-принтере.
Лазерную биопечать можно разделить на два основных класса: основанные на технологиях переноса клеток и фотополимеризации . При лазерной печати с переносом клеток лазер стимулирует связь между энергопоглощающим материалом (например, золотом, титаном и т. д.) и биочернилами. Этот «донорский слой» испаряется под воздействием лазера, образуя пузырь из слоя биочернил, который осаждается из струи. [28] Методы фотополимеризации скорее используют фотоинициируемые реакции для затвердевания чернил, перемещая траекторию луча лазера, чтобы вызвать образование желаемой конструкции. Определенные частоты лазера в сочетании с реакциями фотополимеризации можно проводить без повреждения клеток материала.
При этой форме печати остатки пластика расплавляются и наслаиваются на отдельные секции для создания желаемой формы. Нейлон и ПВА являются примерами биоматериалов, используемых в этом методе. Этот метод чаще всего используется для проектирования прототипов протезов и хрящевых конструкций. [29]
Другая форма биопечати включает струйный принтер, который в основном используется в биомедицинских целях. Этот метод печатает подробные белки и нуклеиновые кислоты. [29] В качестве биочернил обычно выбирают гидрогели. Клетки можно напечатать на выбранном поверхностном носителе для размножения и, в конечном итоге, дифференцировки. Недостатком этого метода печати является способность биочернил, таких как гидрогели, засорять печатное сопло из-за их высокой вязкости. [29] Идеальная струйная биопечать предполагает использование полимера с низкой вязкостью (в идеале ниже 10 сантипуаз), низкой плотностью клеток (<10 миллионов клеток/мл) и низкой структурной высотой (<10 миллионов клеток/мл). [30]
Есть несколько других методов биопечати, которые используются реже. Биопечать на основе капель — это метод, при котором смесь биочернил клеток и/или гидрогелей помещается в капли в определенных положениях. Наиболее распространенными среди этого подхода являются термические и пьезоэлектрические методы «капля по требованию». [31] Этот метод биопечати часто используется экспериментально на моделях рака легких и яичников. [32] Термальные технологии используют кратковременные сигналы для нагрева биочернил, вызывая образование маленьких пузырьков, которые выбрасываются. При пьезоэлектрической биопечати на пьезоэлектрический привод подается кратковременный ток , который вызывает механическую вибрацию, способную выбросить небольшую каплю биочернил через сопло. Важным аспектом изучения капельных подходов к биопечати является учет механических и термических напряжений клеток в процессе воздействия биочернил вблизи кончика сопла при их экструзии.
Биочернила являются важными компонентами процесса биопечати. Они состоят из живых клеток и ферментных добавок, создающих среду, поддерживающую биологические потребности напечатанной ткани. [33] Среда, создаваемая биочернилами, позволяет клетке прикрепляться, расти и дифференцироваться во взрослую форму. [33] Гидрогели, инкапсулирующие клетки, используются в методах биопечати на основе экструзии, в то время как желатин-метакрилоилжелатин-метакрилон (GelMA) и бесклеточные биочернила чаще всего используются в методах тканевой инженерии, которые требуют поперечных связей и точной структурной целостности. [33] Очень важно, чтобы биочернила помогали воспроизводить внешнюю среду клеточного матрикса, в которой естественным образом возникает клетка.
3D-биопечать можно использовать для реконструкции тканей из различных областей тела. Предшественником внедрения 3D-печати в здравоохранении стала серия испытаний, проведенных исследователями Бостонской детской больницы. Команда вручную изготовила запасные мочевые пузыри для семи пациентов, построив каркасы, а затем наложив на них слои клеток пациентов и позволив им расти. Испытания прошли успешно, поскольку пациенты оставались в добром здравии в течение 7 лет после имплантации, что побудило научного сотрудника по имени Энтони Атала, доктора медицинских наук, искать способы автоматизации процесса. [34] Пациентов с терминальной стадией заболевания мочевого пузыря теперь можно лечить с помощью биоинженерных тканей мочевого пузыря для восстановления поврежденного органа. [35] Эту технологию также потенциально можно применять к костям, коже, хрящам и мышечной ткани. [36] Однако одной из долгосрочных целей технологии 3D-биопечати является реконструкция целого органа, а также минимизация проблемы нехватки органов для трансплантации. [37] Биопечать полностью функциональных органов, например, печени, кожи, мениска или поджелудочной железы, не имела большого успеха. [38] [39] [40] В отличие от имплантируемых стентов, органы имеют сложную форму, и их значительно сложнее биопринтировать. Биопечатное сердце, например, должно отвечать не только структурным требованиям, но также требованиям к васкуляризации, механической нагрузке и распространению электрического сигнала. [41] В 2022 году было сообщено о первом успехе клинического испытания 3D-биопечатного трансплантата, изготовленного из собственных клеток пациента, наружного уха для лечения микротии [ 42] . [43]
3D-биопечать способствует значительному прогрессу в медицинской области тканевой инженерии , позволяя проводить исследования инновационных материалов, называемых биоматериалами . Некоторые из наиболее известных биоинженерных веществ обычно прочнее обычных материалов тела, включая мягкие ткани и кости. Эти компоненты могут в будущем заменить или даже улучшить исходные материалы корпуса. Кроме того, Агентство по уменьшению угроз Министерства обороны стремится печатать мини-органы, такие как сердце, печень и легкие, что позволит более точно тестировать новые лекарства и, возможно, устранить необходимость испытаний на животных. [14]
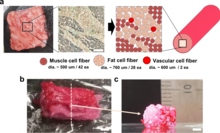
Биопечать также может быть использована для выращивания мяса . В 2021 году было произведено культивированное мясо, похожее на стейк, состоящее из трех типов волокон бычьих клеток. Говядина типа Вагю имеет структуру, похожую на оригинальное мясо. [44] [45] Эта технология обеспечивает альтернативу естественным методам сбора мяса, если животноводство страдает от болезней. Кроме того, это обеспечивает возможное решение по снижению воздействия животноводства на окружающую среду.
Биоремедиация использует микроорганизмы или, в последнее время, материалы биологического происхождения, такие как ферменты , биокомпозиты , биополимеры или наночастицы , для биохимического разложения загрязняющих веществ до безвредных веществ, что делает его экологически чистой и экономически эффективной альтернативой; 3D-биопечать облегчает изготовление функциональных структур с использованием этих материалов, которые улучшают процессы биоремедиации, что приводит к значительному интересу к применению 3D-биопечатных конструкций для улучшения биоремедиации. [3]
Для биопечати биопленок используются те же методы, что и для другой биопечати. Часто биопленка начинается с экструзии полисахарида, обеспечивающего структуру для роста биопленки. Примером одного из таких полисахаридов является альгинат. Альгинатная структура может содержать внедренные в нее микробы. [46] Гидрогели также можно использовать для формирования функциональных биопленок. [2] Биопленки трудно анализировать в лабораторных условиях из-за сложной структуры и времени, необходимого для формирования функциональной биопленки. 3D-биопечать биопленок позволяет нам пропустить определенные процессы и упрощает анализ функциональных биопленок. [46] Толщина печатаемой биопленки меняет функциональность из-за диффузии питательных веществ и кислорода. Более толстые биопленки, напечатанные на 3D-принтере, естественным образом отбирают, например, анаэробы. [47]
Биопленки способны к восстановлению в естественной среде, что предполагает наличие потенциала в отношении использования 3D-биопечатной биопленки для восстановления окружающей среды . [48] Микробы способны разлагать широкий спектр химических веществ и металлов, и создание структуры для процветания этих микробов, например, в структурах биопленок, является полезным. [49] Искусственные биопленки защищают микробы от опасностей окружающей среды, одновременно способствуя передаче сигналов и общим микробным взаимодействиям. [50] 3D-биопечать позволяет помещать функциональные микроорганизмы в структуры, обеспечивающие механическую стабильность и защищающие их от условий окружающей среды. [10] [3] Большая площадь контакта, обеспечиваемая структурами, напечатанными на 3D-принтере, по сравнению с обычными конструкциями, обеспечивающими защиту окружающей среды, обеспечивает более эффективное удаление загрязняющих веществ. [10] [3]
Биопечать также может быть использована в будущем для очистки сточных вод и борьбы с коррозией. [46] Когда люди вступают в контакт с биопленками окружающей среды, возможно возникновение инфекций и долгосрочных опасностей для здоровья. [50] Проникновение и распространение антибиотиков в биопленке — это область исследований, в которой могут быть полезны методы биопечати для дальнейшего изучения влияния биопленок окружающей среды на здоровье человека. [10] Печать биопленок требует дальнейших исследований из-за ограниченности опубликованных данных и сложных протоколов.