
Биоматериал — это вещество, созданное для взаимодействия с биологическими системами в медицинских целях: терапевтических (лечение, усиление, восстановление или замена функций тканей организма) или диагностических . Соответствующей области исследований, называемой биоматериаловедением или инженерией биоматериалов , около пятидесяти лет. На протяжении всей своей истории он пережил устойчивый и сильный рост, при этом многие компании инвестировали большие суммы денег в разработку новых продуктов. Наука о биоматериалах включает в себя элементы медицины , биологии , химии , тканевой инженерии и материаловедения .
Обратите внимание, что биоматериал отличается от биологического материала, такого как кость , который производится биологической системой . Кроме того, следует проявлять осторожность при определении биоматериала как биосовместимого , поскольку он зависит от области применения. Биоматериал, который является биосовместимым или подходит для одного применения, может быть не биосовместимым в другом. [1]
Материал , используемый в контакте с живыми тканями, организмами или микроорганизмами. [2] [а] [б] [в]
Биоматериалы могут быть получены либо из природы, либо синтезированы в лаборатории с использованием различных химических подходов с использованием металлических компонентов, полимеров , керамики или композитных материалов . Они часто используются и/или адаптируются для медицинского применения и, таким образом, представляют собой всю или часть живой структуры или биомедицинского устройства, которое выполняет, дополняет или заменяет естественную функцию. Такие функции могут быть относительно пассивными, например, для сердечного клапана , или, возможно, биологически активными с более интерактивными функциями, такими как тазобедренные имплантаты, покрытые гидроксиапатитом . Биоматериалы также используются каждый день в стоматологии, хирургии и доставке лекарств. Например, в организм можно поместить конструкцию с импрегнированными фармацевтическими продуктами, что обеспечивает пролонгированное высвобождение лекарства в течение длительного периода времени. Биоматериал также может представлять собой аутотрансплантат , аллотрансплантат или ксенотрансплантат , используемый в качестве трансплантационного материала. [ нужна цитата ]
Способность сконструированного биоматериала вызывать физиологическую реакцию, поддерживающую функцию и производительность биоматериала, известна как биоактивность. Чаще всего в биоактивных очках и биоактивной керамике этот термин относится к способности имплантируемых материалов хорошо связываться с окружающими тканями, выполняя остеокондуктивную или остеопродуктивную роль. [4] Материалы для костных имплантатов часто разрабатываются так, чтобы способствовать росту костей, растворяясь в окружающей жидкости организма. [5] Таким образом, для многих биоматериалов желательна хорошая биосовместимость наряду с хорошей прочностью и скоростью растворения. Обычно о биоактивности биоматериалов судят по биоминерализации поверхности, при которой на поверхности образуется нативный слой гидроксиапатита . В наши дни разработка клинически полезных биоматериалов значительно ускоряется благодаря появлению вычислительных процедур, которые могут предсказывать молекулярные эффекты биоматериалов в терапевтических условиях на основе ограниченных экспериментов in vitro . [6]
Самосборка — наиболее распространенный термин, используемый в современном научном сообществе для описания самопроизвольной агрегации частиц (атомов, молекул, коллоидов , мицелл и т. д.) без влияния каких-либо внешних сил. Известно, что большие группы таких частиц собираются в термодинамически стабильные, структурно четко определенные массивы, весьма напоминающие одну из семи кристаллических систем, встречающихся в металлургии и минералогии (например, гранецентрированную кубическую, объемноцентрированную кубическую и т. д.). . Принципиальное отличие равновесной структуры заключается в пространственном масштабе элементарной ячейки (параметре решетки) в каждом конкретном случае.
Молекулярная самосборка широко встречается в биологических системах и обеспечивает основу широкого спектра сложных биологических структур. Сюда входит новый класс механически превосходных биоматериалов, основанных на микроструктурных особенностях и конструкциях, встречающихся в природе. Таким образом, самосборка также становится новой стратегией в химическом синтезе и нанотехнологиях . Молекулярные кристаллы, жидкие кристаллы, коллоиды, мицеллы, эмульсии , полимеры с фазовым разделением, тонкие пленки и самоорганизующиеся монослои — все это примеры типов высокоупорядоченных структур, которые получаются с помощью этих методов. Отличительной чертой этих методов является самоорганизация. [7] [8] [9]
Почти все материалы можно рассматривать как иерархически структурированные, поскольку изменения в пространственном масштабе вызывают различные механизмы деформации и повреждения. [10] Однако в биологических материалах такая иерархическая организация присуща микроструктуре. Одним из первых примеров этого в истории структурной биологии являются ранние работы Эстбери и Вудса по рассеянию рентгеновских лучей по иерархической структуре волос и шерсти . [11] Например, в кости коллаген является строительным блоком органического матрикса , тройной спирали диаметром 1,5 нм. Эти молекулы тропоколлагена интеркалируются с минеральной фазой ( гидроксиапатитом , фосфатом кальция), образуя фибриллы , которые скручиваются в геликоиды чередующихся направлений. Эти « остоны » являются основными строительными блоками костей, при этом объемное соотношение органической и минеральной фаз составляет примерно 60/40.
На другом уровне сложности кристаллы гидроксиапатита представляют собой минеральные пластинки диаметром примерно от 70 до 100 нм и толщиной 1 нм. Первоначально они зарождаются в промежутках между коллагеновыми фибриллами. [12]
Точно так же иерархия раковины морского ушка начинается на наноуровне, когда органический слой имеет толщину от 20 до 30 нм. Этот слой протекает с монокристаллами арагонита (полиморфной модификации СаСО 3 ), состоящими из «кирпичиков» размерами 0,5 и заканчивающимися слоями примерно 0,3 мм (мезоструктура). [13]
Крабы — это членистоногие, чей панцирь состоит из минерализованного твердого компонента (хрупколомкий) и более мягкого органического компонента, состоящего в основном из хитина . Хрупкий компонент расположен по спирали. Каждый из этих минеральных «стержней» (диаметром 1 мкм) содержит хитин-белковые фибриллы диаметром около 60 нм. Эти фибриллы состоят из каналов диаметром 3 нм, которые соединяют внутреннюю и внешнюю часть оболочки.
Биоматериалы используются в:
Биоматериалы должны быть совместимы с организмом, и часто возникают проблемы биосовместимости , которые необходимо решить, прежде чем продукт можно будет разместить на рынке и использовать в клинических условиях. По этой причине к биоматериалам обычно предъявляются те же требования, что и к новым лекарственным препаратам. [19] [20] Все компании-производители также обязаны обеспечивать отслеживание всей своей продукции, чтобы в случае обнаружения дефектного продукта можно было отследить другие продукты в той же партии.
Сульфат кальция (его α- и β-полугидраты) — хорошо известный биосовместимый материал, широко используемый в качестве заменителя костного трансплантата в стоматологии или в качестве его связующего. [21] [22]
В США 49% из 250 000 процедур замены клапана, выполняемых ежегодно, связаны с имплантацией механического клапана. Наиболее широко используемый клапан — двустворчатый дисковый сердечный клапан или клапан Святого Иуды. Механика включает в себя два полукруглых диска, движущихся вперед и назад, оба из которых обеспечивают поток крови, а также способны образовывать уплотнение от обратного потока. Клапан покрыт пиролитическим углеродом и прикреплен к окружающим тканям сеткой из тканого материала под названием дакрон (торговое название полиэтилентерефталата компании Du Pont ). Сетка позволяет тканям тела расти, включая клапан. [23] [ нужна проверка ]
В большинстве случаев искусственная ткань выращивается из собственных клеток пациента. Однако, когда повреждение настолько велико, что невозможно использовать собственные клетки пациента, выращивают искусственные клетки ткани. Трудность состоит в том, чтобы найти каркас, на котором клетки смогут расти и организовываться. Характеристики каркаса должны заключаться в том, что он биосовместим, клетки могут прилипать к каркасу, механически прочен и биоразлагаем . Одним из успешных каркасов является сополимер молочной и гликолевой кислот . [23]
Как обсуждалось ранее, биоматериалы используются в медицинских устройствах для лечения, помощи или замены функций человеческого организма. Применение конкретного биоматериала должно сочетать необходимый состав, свойства материала, структуру и желаемую реакцию in vivo для выполнения желаемой функции. Определены категории различных желаемых свойств, чтобы максимизировать функциональные результаты. [24] [25]
Реакция хозяина определяется как «реакция организма-хозяина (локальная и системная) на имплантированный материал или устройство». Большинство материалов вступают в реакцию при контакте с телом человека. Успех биоматериала зависит от реакции ткани хозяина на инородный материал. Специфические реакции между тканью хозяина и биоматериалом могут возникать благодаря биосовместимости материала . [25] [26]
На функциональность и долговечность любого имплантируемого медицинского устройства in vivo влияет реакция организма на инородный материал. [27] В организме происходит каскад процессов, определенных в рамках реакции на инородное тело (FBR), чтобы защитить хозяина от инородного материала. Необходимо понимать взаимодействие между устройством и тканью/кровью хозяина, а также тканью/кровью хозяина и устройством, чтобы предотвратить осложнения и отказ устройства.
Повреждение тканей, вызванное имплантацией устройства, вызывает воспалительные и заживляющие реакции во время FBR. Воспалительная реакция возникает в течение двух периодов времени: острой фазы и хронической фазы. Острая фаза возникает в течение первых часов или дней после имплантации и определяется по экссудации жидкости и белка [28] наряду с нейтрофильной реакцией. [29] Во время острой фазы организм пытается очистить и залечить рану, доставляя к месту избыток крови, белков и моноцитов. [30] Продолжающееся воспаление приводит к хронической фазе, которую можно классифицировать по наличию моноцитов, макрофагов и лимфоцитов. [29] Кроме того, образуются кровеносные сосуды и соединительная ткань для заживления ран. [31]
Биосовместимость связана с поведением биоматериалов в различных средах при различных химических и физических условиях. Этот термин может относиться к конкретным свойствам материала без указания того, где и как этот материал будет использоваться. Например, материал может вызывать незначительный иммунный ответ или вообще не вызывать его в данном организме и может или не может интегрироваться с определенным типом клеток или ткани . Иммуноинформированные биоматериалы, которые направляют иммунный ответ, а не пытаются обойти этот процесс, являются многообещающим подходом. [32] Неоднозначность этого термина отражает продолжающееся развитие понимания того, «как биоматериалы взаимодействуют с человеческим телом » и, в конечном итоге, «как эти взаимодействия определяют клинический успех медицинского устройства (например, кардиостимулятора или замены тазобедренного сустава )». Современные медицинские устройства и протезы часто изготавливаются из более чем одного материала, поэтому не всегда достаточно говорить о биосовместимости конкретного материала. [33] Хирургическая имплантация биоматериала в организм запускает воспалительную реакцию организма с последующим заживлением поврежденных тканей. В зависимости от состава имплантируемого материала, поверхности имплантата, механизма усталости и химического разложения возможны и другие реакции. Они могут быть как местными, так и системными. К ним относятся иммунный ответ, реакция инородного тела с изоляцией имплантата сосудистой соединительной тканью, возможное инфицирование и влияние на срок службы имплантата. Реакция «трансплантат против хозяина» — ауто- и аллоиммунное заболевание, имеющее вариабельное клиническое течение. Оно может проявляться как в острой, так и в хронической форме, поражая множество органов и тканей и вызывая серьезные осложнения в клинической практике, как при трансплантации, так и при внедрении биосовместимых материалов. [34]
Биоматериал должен выполнять предназначенную функцию в живом организме, не оказывая негативного влияния на другие ткани и органы организма. Чтобы предотвратить нежелательные взаимодействия органов и тканей, биоматериалы должны быть нетоксичными . Токсичность биоматериала относится к веществам, которые выделяются из биоматериала в условиях in vivo . Биоматериал не должен ничего выделять в окружающую среду, если он не предназначен для этого. Нетоксичность означает, что биоматериал является неканцерогенным, апирогенным , неаллергенным , совместимым с кровью и невоспалительным . [35] Однако биоматериал может быть спроектирован так, чтобы включать токсичность для определенной цели. Например, применение токсичного биоматериала изучается при тестировании иммунотерапии рака in vivo и in vitro . Токсичные биоматериалы открывают возможность манипулировать раковыми клетками и контролировать их. [36] В одном из недавних исследований говорится: «Передовые нанобиоматериалы, включая липосомы , полимеры и диоксид кремния , играют жизненно важную роль в совместной доставке лекарств и иммуномодуляторов . Эти системы доставки на основе нанобиоматериалов могут эффективно стимулировать противоопухолевые иммунные реакции и одновременно снижать токсические побочные эффекты». ." [37] Это яркий пример того, как можно изменить биосовместимость биоматериала для выполнения любой желаемой функции.
Биоразлагаемые биоматериалы относятся к материалам, которые разлагаются в результате естественных ферментативных реакций . Применение биоразлагаемых синтетических полимеров началось в конце 1960-х годов. [38] Биоразлагаемые материалы имеют преимущество перед другими материалами, поскольку они имеют меньший риск вредного воздействия в долгосрочной перспективе. Помимо этических достижений в использовании биоразлагаемых материалов, они также улучшают биосовместимость материалов, используемых для имплантации. [38] Некоторые свойства, включая биосовместимость, важны при рассмотрении различных биоразлагаемых биоматериалов. Биоразлагаемые биоматериалы могут быть синтетическими или природными в зависимости от их источника и типа внеклеточного матрикса (ВКМ). [39]
Некоторые из наиболее часто используемых биосовместимых материалов (или биоматериалов) являются полимерами из-за присущей им гибкости и настраиваемых механических свойств . Медицинские устройства, изготовленные из пластмасс, часто изготавливаются из нескольких избранных материалов, в том числе: сополимер циклического олефина (COC), поликарбонат (PC), полиэфиримид (PEI), поливинилхлорид медицинского назначения (PVC), полиэфирсульфон (PES), полиэтилен (PE), полиэфирэфиркетон ( PEEK) и даже полипропилен (PP). Чтобы гарантировать биосовместимость , существует ряд регламентированных тестов, которые материал должен пройти, чтобы быть сертифицированным для использования. К ним относятся тест на биологическую реактивность Фармакопеи США IV (класс IV Фармакопеи США) и биологическая оценка медицинских изделий Международной организации по стандартизации 10993 (ISO 10993). Основной целью испытаний на биосовместимость является количественная оценка острой и хронической токсичности материала и определение любых потенциальных побочных эффектов в условиях использования. Таким образом, испытания, необходимые для данного материала, зависят от его конечного использования (т. е. кровь, центральная нервная система и т. д.). .). [40]
Двумя свойствами, которые оказывают большое влияние на функциональность биоматериала, являются поверхностные и объемные свойства . [41]
Объемные свойства относятся к физическим и химическим свойствам, которые составляют биоматериал на протяжении всего его срока службы. Их можно специально создавать, чтобы имитировать физико-химические свойства ткани, которую материал заменяет. Это механические свойства, которые возникают из атомной и молекулярной структуры материала.
Важные объемные свойства: [42]
Поверхностные свойства относятся к химическим и топографическим особенностям поверхности биоматериала, который будет напрямую взаимодействовать с кровью/тканями хозяина. [43] Поверхностная инженерия и модификация позволяют клиницистам лучше контролировать взаимодействие биоматериала с живой системой хозяина.
Важные свойства поверхности: [44]
Помимо того, что материал сертифицирован как биосовместимый , биоматериалы должны быть специально разработаны для их целевого применения в составе медицинского устройства . Это особенно важно с точки зрения механических свойств , которые определяют поведение данного биоматериала. Одним из наиболее важных параметров материала является модуль Юнга E , который описывает упругую реакцию материала на напряжения . Модули Юнга ткани и подключаемого к ней устройства должны точно совпадать для обеспечения оптимальной совместимости между устройством и телом, независимо от того, имплантировано ли устройство или установлено снаружи. Согласование модуля упругости позволяет ограничить движение и расслоение на биогранице между имплантатом и тканью, а также избежать концентрации напряжений , которая может привести к механическому разрушению . Другими важными свойствами являются прочность на растяжение и сжатие , которые количественно определяют максимальные напряжения, которые материал может выдержать перед разрушением, и могут использоваться для установки предельных напряжений , которым устройство может подвергаться внутри или снаружи тела. В зависимости от применения может быть желательно, чтобы биоматериал имел высокую прочность, чтобы он был устойчив к разрушению при воздействии нагрузки, однако в других применениях может быть выгодно, чтобы материал имел низкую прочность. Существует тщательный баланс между прочностью и жесткостью, который определяет, насколько устойчиво к поломкам устройство из биоматериала. Обычно по мере увеличения эластичности биоматериала предел прочности на разрыв снижается, и наоборот. Одно из применений, где использование высокопрочного материала нежелательно, - это нейронные зонды ; Если в этих целях используется высокопрочный материал, ткань всегда выйдет из строя раньше устройства (при приложенной нагрузке ), поскольку модуль Юнга твердой мозговой оболочки и ткани головного мозга составляет порядка 500 Па . Когда это происходит, может произойти необратимое повреждение головного мозга, поэтому биоматериал должен иметь модуль упругости, меньший или равный модулю упругости ткани мозга, и низкую прочность на растяжение, если ожидается приложенная нагрузка. [46] [47]
Для имплантируемых биоматериалов, которые могут испытывать колебания температуры , например, зубных имплантатов , важна пластичность . Материал должен быть пластичным по той же причине, что предел прочности на разрыв не может быть слишком высоким, пластичность позволяет материалу сгибаться без разрушения , а также предотвращает концентрацию напряжений в тканях при изменении температуры. Прочность материала также важна для зубных имплантатов, а также для любого другого жесткого имплантата , несущего нагрузку , например, для замены тазобедренного сустава . Прочность описывает способность материала деформироваться под приложенным напряжением без разрушения , а высокая прочность позволяет имплантатам из биоматериала дольше служить в организме, особенно при воздействии больших напряжений или циклических напряжений , таких как напряжения, прикладываемые к тазобедренному суставу во время бега. [46]
Для медицинских устройств, которые имплантируются или прикрепляются к коже, еще одним важным свойством, требующим рассмотрения , является жесткость при изгибе D . Жесткость при изгибе будет определять, насколько хорошо поверхность устройства может поддерживать конформный контакт с поверхностью ткани , что особенно важно для устройств, измеряющих движение ткани ( деформацию ), электрические сигналы ( импеданс ) или предназначенных для прилипания к коже без расслаивания . как в эпидермальной электронике. Поскольку жесткость при изгибе зависит от толщины материала h в третьей степени ( h 3 ), очень важно, чтобы биоматериал мог быть сформирован в тонкие слои в ранее упомянутых приложениях, где конформность имеет первостепенное значение. [48]
Молекулярный состав биоматериала определяет физические и химические свойства биоматериала. Эти композиции создают сложные структуры, которые позволяют биоматериалу функционировать, и поэтому их необходимо определить и понять для разработки биоматериала. биоматериалы могут быть созданы для репликации природных организмов — процесс, известный как биомиметика . [49] Структуру биоматериала можно наблюдать на разных уровнях, чтобы лучше понять свойства и функции материалов.

Расположение атомов и ионов внутри материала является одним из наиболее важных структурных свойств биоматериала. Атомную структуру материала можно рассматривать на разных уровнях: субатомном , атомном или молекулярном уровне, а также ультраструктуру, созданную атомами и молекулами. Межмолекулярные силы между атомами и молекулами, из которых состоит материал, будут определять его материальные и химические свойства. [50]
На субатомном уровне наблюдается электрическая структура отдельного атома, чтобы определить его взаимодействие с другими атомами и молекулами. Молекулярная структура наблюдает за расположением атомов внутри материала. Наконец, ультраструктура наблюдает трехмерную структуру, созданную из атомных и молекулярных структур материала. Твердое состояние материала характеризуется внутримолекулярными связями между атомами и молекулами, составляющими материал. Типы внутримолекулярных связей включают: ионные связи , ковалентные связи и металлические связи . Эти связи будут определять физические и химические свойства материала, а также определять тип материала ( керамика , металл или полимер ).
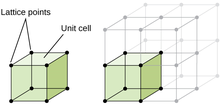
Микроструктура материала относится к структуре объекта, организма или материала, наблюдаемой при увеличении, превышающем 25 раз . [51] Он состоит из фаз различной формы, размера и распределения зерен, пор, осадков и т. д. Большинство твердых микроструктур являются кристаллическими , однако некоторые материалы, такие как определенные полимеры, не кристаллизуются в твердом состоянии. [52]
Кристаллическая структура — это композиция ионов, атомов и молекул, которые удерживаются вместе и упорядочены в трехмерной форме. Основное различие между кристаллической структурой и аморфной структурой заключается в порядке компонентов. Кристаллический имеет максимально возможный уровень порядка в материале, где аморфная структура состоит из неровностей в структуре упорядочения. [53] Одним из способов описания кристаллических структур является кристаллическая решетка , которая представляет собой трехмерное представление местоположения повторяющегося фактора ( элементарной ячейки ) в структуре, обозначенной решетками . [54] Существует 14 различных конфигураций расположения атомов в кристаллической структуре, и все они представлены решетками Браве . [55]
При формировании кристаллической структуры могут образовываться различные примеси, неровности и другие дефекты. Эти дефекты могут образоваться в результате деформации твердого тела, быстрого охлаждения или излучения высокой энергии. [56] Типы дефектов включают точечные дефекты, линейные дефекты, а также краевые дислокации.
Макроструктура относится к общим геометрическим свойствам, которые будут влиять на силу разрушения, жесткость, изгиб, распределение напряжений и вес материала. Чтобы выявить макроструктуру материала, увеличение практически не требуется. Наблюдение за макроструктурой позволяет выявить такие свойства, как полости, пористость , пузырьки газа, расслоение и трещины . [57] Прочность материала и модуль упругости не зависят от макроструктуры.
Биоматериалы могут быть созданы с использованием только материалов, полученных из растений и животных, с целью изменения, замены или восстановления тканей/органов человека. Использование природных биоматериалов применялось еще в Древнем Египте, где коренные жители использовали кожу животных в качестве швов. Более современный пример — замена тазобедренного сустава с использованием материала из слоновой кости, впервые зарегистрированная в Германии в 1891 году. [58]
Ценные критерии жизнеспособных природных биоматериалов:
Примеры природных биоматериалов:
Биополимеры – это полимеры , производимые живыми организмами. Целлюлоза и крахмал , белки и пептиды , ДНК и РНК — все это примеры биополимеров, в которых мономерными единицами являются соответственно сахара , аминокислоты и нуклеотиды . [61] Целлюлоза является одновременно самым распространенным биополимером и самым распространенным органическим соединением на Земле. Около 33% всего растительного вещества составляет целлюлоза. [62] [63] Аналогичным образом, шелк (белковый биополимер) вызвал огромный исследовательский интерес во множестве областей, включая тканевую инженерию и регенеративную медицину, микрофлюидику, доставку лекарств. [64] [65]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )