Антиароматичностью называется химическое свойство циклической молекулы с π-электронной системой , которая имеет более высокую энергию, т. е. она менее стабильна из-за наличия в ней 4n делокализованных (π или неподеленная пара) электронов, в отличие от ароматичности . В отличие от ароматических соединений , которые следуют правилу Хюккеля ([4 n +2] π-электронов) [1] и являются высокостабильными, антиароматические соединения являются высоконестабильными и высокореакционноспособными. Чтобы избежать нестабильности антиароматичности, молекулы могут изменять форму, становясь неплоскими и, следовательно, нарушая некоторые из π-взаимодействий. В отличие от диамагнитного кольцевого тока, присутствующего в ароматических соединениях , антиароматические соединения имеют парамагнитный кольцевой ток, который можно наблюдать с помощью ЯМР-спектроскопии.

Примерами антиароматических соединений являются пентален (A), бифенилен (B), циклопентадиенильный катион (C). Прототипический пример антиароматичности, циклобутадиен , является предметом дебатов, и некоторые ученые утверждают, что антиароматичность не является основным фактором, способствующим его дестабилизации. [2]
Циклооктатетраен является примером молекулы, принимающей неплоскую геометрию, чтобы избежать дестабилизации, которая является результатом антиароматичности. Если бы он был плоским, он имел бы одну восьмиэлектронную π-систему вокруг кольца, но вместо этого он принимает форму лодки с четырьмя отдельными π-связями. [3] Поскольку антиароматические соединения часто являются короткоживущими и с ними трудно работать экспериментально, энергия антиароматической дестабилизации часто моделируется с помощью моделирования, а не эксперимента. [2]
Термин «антиароматичность» был впервые предложен Рональдом Бреслоу в 1967 году как «ситуация, в которой циклическая делокализация электронов является дестабилизирующей». [4] Критерии ИЮПАК для антиароматичности следующие: [5]
Это отличается от ароматичности только четвертым критерием: ароматические молекулы имеют 4 n +2 π-электронов в сопряженной π-системе и поэтому следуют правилу Хюккеля . Неароматические молекулы либо нецикличны, либо неплоски, либо не имеют полной сопряженной π-системы внутри кольца.
Наличие плоской кольцевой системы необходимо для максимизации перекрытия между p -орбиталями, которые составляют сопряженную π-систему. Это объясняет, почему плоская циклическая молекула является ключевой характеристикой как ароматических, так и антиароматических молекул. Однако в действительности трудно определить, полностью ли сопряжена молекула, просто взглянув на ее структуру: иногда молекулы могут деформироваться, чтобы снять напряжение, и это искажение может нарушить сопряжение. Таким образом, необходимо предпринять дополнительные усилия, чтобы определить, является ли определенная молекула действительно антиароматической. [6]
Антиароматическое соединение может демонстрировать свою антиароматичность как кинетически, так и термодинамически. Как будет обсуждаться позже, антиароматические соединения проявляют исключительно высокую химическую реактивность (высокая реактивность не является «показательной» для антиароматического соединения, она просто предполагает, что соединение может быть антиароматическим). Антиароматическое соединение также может быть распознано термодинамически путем измерения энергии циклической сопряженной π-электронной системы. В антиароматическом соединении количество энергии сопряжения в молекуле будет значительно выше, чем в соответствующем эталонном соединении. [7]
В действительности рекомендуется тщательно проанализировать структуру потенциально антиароматического соединения, прежде чем заявлять, что оно действительно антиароматическое. Если экспериментально определенной структуры рассматриваемой молекулы не существует, необходимо провести вычислительный анализ. Потенциальная энергия молекулы должна быть исследована для различных геометрий, чтобы оценить любые искажения от симметричной плоской конформации. [6] Эта процедура рекомендуется, поскольку в прошлом было много случаев, когда молекулы, которые на бумаге кажутся антиароматическими, на самом деле не были таковыми. Самой известной (и активно обсуждаемой) из этих молекул является циклобутадиен, как обсуждается далее.
Примерами антиароматических соединений являются пентален (A), бифенилен (B), циклопентадиенильный катион (C). Прототипический пример антиароматичности, циклобутадиен , является предметом дебатов, и некоторые ученые утверждают, что антиароматичность не является основным фактором, способствующим его дестабилизации. [2] Циклооктатетраен на первый взгляд кажется антиароматическим, но является прекрасным примером молекулы, принимающей неплоскую геометрию, чтобы избежать дестабилизации, которая является результатом антиароматичности. [3] Поскольку антиароматические соединения часто являются короткоживущими и с ними трудно работать экспериментально, энергия антиароматической дестабилизации часто моделируется с помощью моделирования, а не эксперимента. [2]
Парамагнитный кольцевой ток, возникающий в результате делокализации электронов в антиароматических соединениях, можно наблюдать с помощью ЯМР . Этот кольцевой ток приводит к деэкранированию (сдвигу вниз по полю) ядер внутри кольца и экранированию (сдвигу вверх по полю) ядер за пределами кольца. [12]Аннулен — это антиароматический углеводород, который достаточно большой, чтобы иметь протоны как внутри, так и снаружи кольца. Химический сдвиг для протонов за пределами его кольца составляет 5,91 ppm, а для протонов внутри кольца — 7,86 ppm по сравнению с нормальным диапазоном 4,5–6,5 ppm для неароматических алкенов. Этот эффект имеет меньшую величину, чем соответствующие сдвиги в ароматических соединениях. [8]
Многие ароматические и антиароматические соединения (бензол и циклобутадиен) слишком малы, чтобы иметь протоны внутри кольца, где экранирующие и деэкранирующие эффекты могут быть более диагностически полезны для определения того, является ли соединение ароматическим, антиароматическим или неароматическим. Анализ ядерного независимого химического сдвига (NICS) — это метод вычисления экранирования кольца (или деэкранирования) в центре кольцевой системы для прогнозирования ароматичности или антиароматичности. Отрицательное значение NICS указывает на ароматичность, а положительное значение указывает на антиароматичность. [9]
Хотя существует множество молекул, которые на бумаге кажутся антиароматическими, число молекул, которые являются антиароматическими на самом деле, значительно меньше. Это усугубляется тем фактом, что обычно невозможно создать производные антиароматических молекул путем добавления большего количества антиароматических углеводородных колец и т. д., поскольку молекула обычно теряет либо свою плоскую природу, либо свою сопряженную систему π-электронов и становится неароматической. [10] В этом разделе включены только примеры антиароматических соединений, которые не вызывают сомнений.
Пентален — антиароматическое соединение, которое было хорошо изучено как экспериментально, так и вычислительно в течение десятилетий. Он является дициклическим, плоским и имеет восемь π-электронов, что соответствует определению антиароматичности IUPAC. Дианионные и дикатионные состояния пенталена являются ароматическими, поскольку они следуют правилу Хюккеля 4 n +2 π-электронов. [11]

Как и его родственник [12]аннулен , гексадегидро-[12]аннулен также является антиароматическим. Его структура была изучена вычислительно с помощью ab initio и теории функционала плотности и подтверждено, что он является антиароматическим. [12]
Циклобутадиен — классический хрестоматийный пример антиароматического соединения. Его обычно считают плоским, циклическим и имеющим 4 π-электрона (4 n для n = 1) в сопряженной системе.

Однако долгое время ставилось под сомнение, является ли циклобутадиен действительно антиароматическим, и недавние открытия показали, что это может быть не так. Циклобутадиен особенно дестабилизирован, и это изначально приписывалось антиароматичности. Однако циклобутадиен принимает больше характера двойной связи в двух из его параллельных связей, чем другие, и π-электроны не делокализованы между двумя связями, подобными двойным связям, что придает ему прямоугольную форму, а не правильную квадратную. [3] Таким образом, циклобутадиен ведет себя как два дискретных алкена, соединенных двумя одинарными связями, и поэтому является неароматическим, а не антиароматическим.
Несмотря на отсутствие этого π-антиароматического дестабилизирующего эффекта, ни один из его 4 n π-электронных родственников (циклооктатетраен и т. д.) не имел даже близкой к такой дестабилизации, что предполагает, что в случае циклобутадиена происходит что-то большее. Было обнаружено, что сочетание угловой деформации , торсионной деформации и отталкивания Паули приводит к экстремальной дестабилизации, испытываемой в этой молекуле. [2]
Это открытие неловко, поскольку оно противоречит основным учениям об антиароматичности. На данный момент предполагается, что циклобутадиен будет по-прежнему использоваться для введения концепции антиароматичности в учебниках в качестве удобства, даже если классификация его как антиароматического технически может быть неточной.
Циклопентадиенильный катион — еще один хрестоматийный пример антиароматического соединения. Его обычно считают плоским, циклическим и имеющим 4 π-электрона (4 n для n = 1) в сопряженной системе.
Однако долгое время ставилось под сомнение, является ли циклопентадиенильный катион действительно антиароматическим, и недавние открытия предполагают, что это может быть не так. Синглетное состояние с самой низкой энергией является антиароматическим, но триплетное состояние с самой низкой энергией является ароматическим из-за правила Бэрда , а исследования 2007 года показали, что триплетное состояние является основным состоянием . [13]

Циклооктатетраен — еще один пример молекулы, которая не является антиароматической, хотя на первый взгляд может показаться, что она таковой является. Циклооктатетраен принимает конформацию ванны (т.е. лодкообразную). Поскольку он не является плоским, хотя у него есть 4 n π-электронов, эти электроны не делокализованы и не сопряжены. Следовательно, молекула неароматическая. [3]
Антиароматические соединения, часто очень нестабильные, могут быть высокореактивными, чтобы ослабить антиароматическую дестабилизацию. Циклобутадиен, например, быстро димеризуется без потенциального энергетического барьера через реакцию циклоприсоединения 2 + 2 с образованием трициклооктадиена. [14] Хотя антиароматический характер циклобутадиена является предметом споров, ослабление антиароматичности обычно рассматривается как движущая сила этой реакции.

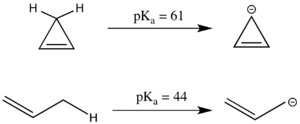
Антиароматичности также могут оказывать значительное влияние на p K a . Линейное соединение пропен имеет ap K a 44, что является относительно кислым для sp 3 углеродного центра, поскольку полученный аллильный анион может быть резонансно стабилизирован. Аналогичная циклическая система, по-видимому, имеет еще большую резонансную стабилизацию, поскольку отрицательный заряд может быть делокализован по трем атомам углерода вместо двух. Однако циклопропенил-анион имеет 4 π-электрона в циклической системе и фактически имеет существенно более высокий p K a , чем 1-пропен, поскольку он антиароматичен и, таким образом, дестабилизирован. [3] Поскольку антиароматические соединения часто являются короткоживущими и с ними трудно работать экспериментально, энергия антиароматической дестабилизации часто моделируется с помощью моделирования, а не эксперимента. [2]
Некоторые антиароматические соединения стабильны, особенно более крупные циклические системы (в которых антиароматическая дестабилизация не столь существенна). Например, ароматический вид 1 может быть уменьшен до 2 с относительно небольшим штрафом за образование антиароматической системы. Антиароматический вид 2 со временем возвращается к ароматическому виду 1 , реагируя с кислородом в воздухе, поскольку ароматичность предпочтительна. [15]

Потеря антиароматичности иногда может быть движущей силой реакции. В последующей кето-енольной таутомеризации продукт енол более стабилен, чем исходный кетон, даже несмотря на то, что кетон содержит ароматическую бензольную часть (синюю). Однако есть также антиароматическая лактонная часть (зеленую). Облегчение антиароматической дестабилизации обеспечивает движущую силу, которая перевешивает даже потерю ароматического бензола. [16]
