Антитромбин (АТ) – небольшой гликопротеин , инактивирующий некоторые ферменты системы свертывания крови . Это белок, состоящий из 464 аминокислот, вырабатываемый печенью . Он содержит три дисульфидные связи и четыре возможных сайта гликозилирования . α-Антитромбин является доминирующей формой антитромбина, обнаруженной в плазме крови , и имеет олигосахарид, занимающий каждый из четырех сайтов гликозилирования. Единственный сайт гликозилирования остается неизменно незанятым в минорной форме антитромбина, β-антитромбине. [5] Его активность многократно увеличивается антикоагулянтом гепарином , который усиливает связывание антитромбина с фактором IIa (тромбином) и фактором Ха . [6]
Антитромбин также называют антитромбином III (АТ III). Обозначения от антитромбина I до антитромбина IV возникли в ранних исследованиях, проведенных в 1950-х годах Сигерсом, Джонсоном и Феллом. [7]
Антитромбин I (AT I) относится к связыванию тромбина с фибрином после того, как тромбин активировал фибриноген , в некаталитическом сайте связывания тромбина. Антитромбин II (АТ II) относится к кофактору плазмы, который вместе с гепарином препятствует взаимодействию тромбина и фибриногена . Антитромбин III (АТ III) относится к веществу в плазме , которое инактивирует тромбин. Антитромбин IV (АТ IV) относится к антитромбину, который активируется во время и вскоре после свертывания крови . [8] Только AT III и, возможно, AT I имеют медицинское значение. AT III обычно называют исключительно «антитромбином», и именно антитромбин III обсуждается в этой статье.

Период полувыведения антитромбина в плазме крови составляет около 3 дней. [9] Нормальная концентрация антитромбина в плазме крови человека составляет примерно 0,12 мг/мл, что эквивалентно молярной концентрации 2,3 мкМ. [10] Антитромбин был выделен из плазмы большого числа видов, помимо человека. [11] Как показало секвенирование белков и кДНК , все антитромбины коров, овец, кроликов и мышей состоят из 433 аминокислот, что на одну аминокислоту длиннее человеческого антитромбина. Считается, что дополнительная аминокислота находится в положении аминокислоты 6. Антитромбины коров, овец, кроликов, мышей и человека имеют идентичность аминокислотных последовательностей от 84 до 89%. [12] Шесть аминокислот образуют три внутримолекулярные дисульфидные связи : Cys 8-Cys128, Cys21-Cys95 и Cys248-Cys430. Все они имеют четыре потенциальных сайта N-гликозилирования . Они встречаются с аминокислотами аспарагина (Asn) под номерами 96, 135, 155 и 192 у людей и с аналогичными номерами аминокислот у других видов. Все эти сайты заняты ковалентно присоединенными боковыми цепями олигосахаридов в преобладающей форме человеческого антитромбина, α-антитромбине, в результате чего молекулярная масса этой формы антитромбина равна 58 200. [5] Потенциальный сайт гликозилирования аспарагина 135 не занят минорной формой (около 10%) антитромбина, β-антитромбина (см. рисунок 1 ). [13]
Рекомбинантные антитромбины со свойствами, аналогичными свойствам нормального человеческого антитромбина, были получены с использованием инфицированных бакуловирусом клеток насекомых и линий клеток млекопитающих, выращенных в культуре клеток . [14] [15] [16] [17] Эти рекомбинантные антитромбины обычно имеют паттерны гликозилирования, отличные от нормального антитромбина, и обычно используются в структурных исследованиях антитромбина. По этой причине многие структуры антитромбина, хранящиеся в банке данных по белкам и представленные в этой статье, демонстрируют переменные паттерны гликозилирования.
Антитромбин начинается в нативном состоянии, которое имеет более высокую свободную энергию по сравнению со латентным состоянием, до которого он распадается в среднем через 3 дня. Латентное состояние имеет ту же форму, что и активированное состояние, то есть когда происходит ингибирование тромбина. По сути, это классический пример преимуществ кинетического и термодинамического контроля сворачивания белка.


Антитромбин представляет собой серпин (ингибитор сериновой протеазы) и, таким образом, по структуре похож на большинство других ингибиторов протеаз плазмы , таких как альфа-1-антихимотрипсин , альфа-2-антиплазмин и кофактор гепарина II .
Физиологическими протеазами- мишенями антитромбина являются протеазы контактного пути активации (ранее известного как внутренний путь), а именно активированные формы фактора X (Xa), фактора IX (IXa), фактора XI (XIa), фактора XII (XIIa). и, в большей степени, фактор II (тромбин) (IIa), а также активированную форму фактора VII (VIIa) пути тканевого фактора (ранее известного как внешний путь). [20] Ингибитор также инактивирует калликреин и плазмин , которые также участвуют в свертывании крови. Однако он инактивирует некоторые другие сериновые протеазы, которые не участвуют в коагуляции, такие как трипсин и субъединицу C1s фермента C1, участвующего в классическом пути комплемента . [12] [21]
Инактивация протеазы возникает вследствие захвата протеазы в эквимолярный комплекс с антитромбином, в котором активный центр фермента протеазы недоступен для ее обычного субстрата . [12] Образование комплекса антитромбин-протеаза включает взаимодействие между протеазой и специфической реактивной пептидной связью внутри антитромбина. В человеческом антитромбине эта связь находится между аргинином (arg) 393 и серином (ser) 394 (см. Фигуру 2 и Фигуру 3 ). [12]
Считается, что ферменты протеазы оказываются в ловушке неактивных комплексов антитромбин-протеаза в результате их атаки на реактивную связь. Хотя атака аналогичной связи внутри нормального субстрата протеазы приводит к быстрому протеолитическому расщеплению субстрата, инициирование атаки на реактивную связь с антитромбином приводит к активации антитромбина и захвату фермента на промежуточной стадии протеолитического процесса. Со временем тромбин способен расщепить реактивную связь внутри антитромбина, и неактивный комплекс антитромбин-тромбин диссоциирует, однако время, необходимое для этого, может превышать 3 дня. [22] Однако связи P3-P4 и P1'-P2' могут быть быстро расщеплены нейтрофильной эластазой и бактериальным ферментом термолизином соответственно, в результате чего неактивные антитромбины больше не способны ингибировать активность тромбина. [23]
Скорость ингибирования антитромбином активности протеазы значительно увеличивается за счет его дополнительного связывания с гепарином , а также его инактивации нейтрофильной эластазой . [23]
Антитромбин инактивирует свои физиологические ферменты-мишени, тромбин, фактор Ха и фактор IXa, с константами скорости 7–11 x 10 3 , 2,5 x 10 3 M -1 с -1 и 1 x 10 M -1 с -1 соответственно. [5] [24] Скорость инактивации антитромбина-тромбина увеличивается до 1,5 - 4 х 10 7 М -1 с -1 в присутствии гепарина, т.е. реакция ускоряется в 2000-4000 раз. [25] [26] [27] [28] Ингибирование фактора Ха ускоряется только в 500–1000 раз в присутствии гепарина, а максимальная константа скорости в 10 раз ниже, чем у ингибирования тромбина. [25] [28] Скорость усиления ингибирования антитромбина-фактора IXa увеличивается примерно в 1 миллион раз в присутствии гепарина и физиологических уровней кальция . [24]
AT-III связывается со специфической сульфатированной последовательностью пентасахарида, содержащейся в полимере гепарина.
GlcNAc/NS(6S)-GlcA-GlcNS(3S,6S)-IdoA(2S)-GlcNS(6S)
При связывании с этой пентасахаридной последовательностью ингибирование активности протеазы усиливается гепарином в результате двух различных механизмов. [29] В одном из механизмов стимуляция гепарином фактора IXa и ингибирование Ха зависит от конформационного изменения антитромбина, включающего петлю реактивного сайта, и, таким образом, является аллостерическим . [30] В другом механизме стимуляция ингибирования тромбина зависит от образования тройного комплекса между АТ-III, тромбином и гепарином. [30]

Повышенное ингибирование факторов IXa и Ха требует минимальной последовательности пентасахарида гепарина. Конформационные изменения, которые происходят в антитромбине в ответ на связывание пентасахарида, хорошо документированы. [18] [31] [32]
В отсутствие гепарина аминокислоты P14 и P15 (см. рисунок 3 ) из петли реактивного центра встроены в основную часть белка (в частности, в верхнюю часть бета-листа A). Эта особенность является общей с другими серпинами, такими как кофактор гепарина II , альфа-1-антихимотрипсин и MENT .
Конформационное изменение, наиболее значимое для ингибирования факторов IXa и Ха, затрагивает аминокислоты P14 и P15 в N-концевой области петли реактивного сайта (обведено кружком на рисунке 4, модель B ). Эту область назвали шарнирной областью. Конформационное изменение внутри шарнирной области в ответ на связывание гепарина приводит к изгнанию P14 и P15 из основной части белка, и было показано, что предотвращение этого конформационного изменения не приводит к усилению ингибирования факторов IXa и Ха. [30] Считается, что повышенная гибкость, придаваемая петле реактивного сайта в результате конформационного изменения шарнирной области, является ключевым фактором, влияющим на усиление ингибирования факторов IXa и Ха. Подсчитано, что в отсутствие пентасахарида только одна из каждых 400 молекул антитромбина (0,25%) находится в активной конформации с удаленными аминокислотами Р14 и Р15. [30]
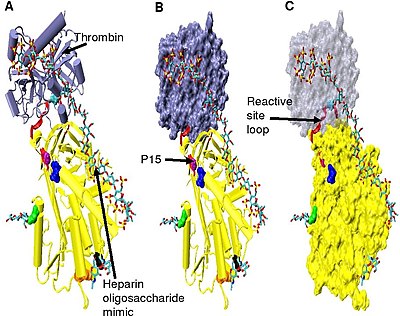
Для усиления ингибирования тромбина требуется минимальное количество пентасахарида гепарина плюс, по меньшей мере, дополнительные 13 мономерных единиц. [33] Считается, что это связано с требованием, чтобы антитромбин и тромбин связывались с одной и той же цепью гепарина, прилегающей друг к другу. Это можно увидеть в серии моделей, показанных на рисунке 5 .
В структурах, показанных на фигуре 5, С-концевая часть (P'-сторона) петли реактивного сайта находится в расширенной конформации по сравнению с другими неактивированными или активированными гепарином антитромбиновыми структурами. [34] P'-область антитромбина необычно длинна по сравнению с P'-областью других серпинов и в неактивированных или активированных гепарином антитромбиновых структурах образует прочно связанный водородными связями β-поворот . Удлинение P' происходит за счет разрыва всех водородных связей, участвующих в β-повороте . [34]
Шарнирную область антитромбина в комплексе на фигуре 5 невозможно смоделировать из-за ее конформационной гибкости, а аминокислоты P9-P14 не наблюдаются в этой структуре. Эта конформационная гибкость указывает на то, что внутри комплекса может существовать равновесие между конформацией антитромбина, в которую вставлена петля реактивного сайта P14 P15, и конформацией исключенной петли реактивного сайта P14 P15. В подтверждение этого анализ положения P15 Gly в комплексе на рисунке 5 (обозначенном в модели B) показывает, что он вставлен в бета-лист A (см. модель C). [34]
α-Антитромбин и β-антитромбин различаются по сродству к гепарину. [35] Разница в константе диссоциации между ними трехкратная для пентасахарида, показанного на рисунке 3 , и более чем десятикратная для полноразмерного гепарина, при этом β-антитромбин имеет более высокое сродство. [36] Считается, что более высокое сродство β-антитромбина связано с повышенной скоростью, с которой происходят последующие конформационные изменения внутри белка при первоначальном связывании гепарина. Считается, что для α-антитромбина дополнительное гликозилирование Asn-135 не мешает первоначальному связыванию гепарина, а скорее ингибирует любые возникающие конформационные изменения. [35]
Несмотря на то, что он присутствует только на уровне 5–10% от уровней α-антитромбина, из-за его повышенного сродства к гепарину считается, что β-антитромбин более важен, чем α-антитромбин, в контроле тромбогенных событий, возникающих в результате повреждения тканей. Действительно, ингибирование тромбина после повреждения аорты приписывают исключительно β-антитромбину. [37]
Доказательства важной роли антитромбина в регуляции нормального свертывания крови подтверждаются корреляцией между наследственным или приобретенным дефицитом антитромбина и повышенным риском развития тромботических заболеваний у любого больного. [38] Дефицит антитромбина обычно выявляется, когда пациент страдает рецидивирующим венозным тромбозом и тромбоэмболией легочной артерии .
Приобретенный дефицит антитромбина возникает в результате трех совершенно разных механизмов. Первым механизмом является повышенная экскреция, которая может возникнуть при почечной недостаточности, связанной с нефротическим синдромом протеинурии . Второй механизм возникает в результате снижения продукции, что наблюдается при печеночной недостаточности или циррозе печени или незрелости печени вследствие преждевременных родов . Третий механизм возникает в результате ускоренного потребления, которое наиболее выражено в результате тяжелой травмы, но также может наблюдаться в меньшем масштабе в результате таких вмешательств, как обширное хирургическое вмешательство или искусственное кровообращение . [39]
Частота наследственного дефицита антитромбина оценивается в пределах от 1:2000 до 1:5000 среди нормальной популяции, причем первая семья, страдающая от наследственного дефицита антитромбина, была описана в 1965 году. [40] [41] Впоследствии было предложено, чтобы Классификация наследственного дефицита антитромбина может быть обозначена как тип I или тип II на основании функционального и иммунохимического анализа антитромбина. [42] Поддержание адекватного уровня активности антитромбина, который составляет не менее 70% от нормального функционального уровня, необходимо для обеспечения эффективного ингибирования протеаз свертывания крови. [43] Обычно в результате дефицита антитромбина типа I или типа II функциональные уровни антитромбина снижаются до уровня ниже 50% от нормального. [44]
Дефицит антитромбина I типа характеризуется снижением как антитромбиновой активности, так и концентрации антитромбина в крови больных. Дефицит типа I первоначально был разделен на две подгруппы: Ia и Ib, в зависимости от сродства к гепарину. Антитромбин лиц подгруппы Ia показал нормальное сродство к гепарину, тогда как антитромбин лиц подгруппы Ib показал пониженное сродство к гепарину. [45] Последующий функциональный анализ группы случаев 1b выявил не только снижение сродства к гепарину, но и множественные или «плейотрофические» нарушения, влияющие на реактивный сайт, сайт связывания гепарина и концентрацию антитромбина в крови. В пересмотренной системе классификации, принятой Комитетом по науке и стандартизации Международного общества тромбозов и гемостаза, случаи типа Ib теперь обозначаются как ТЭЛА типа II, плейотрофический эффект. [46]
Большинство случаев дефицита I типа обусловлены точечными мутациями , делециями или незначительными вставками в гене антитромбина. Эти генетические мутации приводят к дефициту типа I посредством различных механизмов:
Дефицит антитромбина II типа характеризуется нормальным уровнем антитромбина, но сниженной активностью антитромбина в крови больных людей. Первоначально было предложено разделить дефицит II типа на три подгруппы (IIa, IIb и IIc) в зависимости от того, функциональная активность антитромбина снижается или сохраняется. [45]
В пересмотренной системе классификации, вновь принятой Комитетом по науке и стандартизации Международного общества по тромбозам и гемостазу, дефицит антитромбина типа II по-прежнему подразделяется на три подгруппы: уже упомянутый PE типа II наряду с RS типа II, где мутации влияют на реактивный сайт и HBS типа II, где мутации влияют на сайт связывания антитромбина и гепарина. [46] Для целей базы данных мутаций антитромбина, составленной членами Подкомитета по ингибиторам плазменной коагуляции Комитета по науке и стандартизации Международного общества по тромбозам и гемостазу, случаи типа IIa теперь классифицируются как ТЭЛА типа II, случаи типа IIb - как RS типа II и случаи типа IIc, как HBS типа II. [49]
В настоящее время относительно легко охарактеризовать специфическую генетическую мутацию антитромбина. Однако до использования современных методов характеристики исследователи называли мутации в честь города, в котором проживал человек, страдающий от дефицита, т.е. мутация антитромбина обозначалась топонимом . [50] С тех пор современная мутационная характеристика показала, что многие отдельные топонимы антитромбина на самом деле являются результатом одной и той же генетической мутации, например антитромбин-Тояма эквивалентен антитромбину-Кумамото, -Амьен, -Тур, -Париж-1, -Париж. -2, -Алжир, -Падуя-2 и -Барселона. [49]
Антитромбин используется в качестве белкового терапевтического препарата , который может быть очищен из плазмы человека [51] или получен рекомбинантным путем (например, атрин, который производится в молоке генетически модифицированных коз [52] [53] ).
Он одобрен FDA в качестве антикоагулянта для предотвращения образования тромбов до, во время или после операции или родов у пациентов с наследственной недостаточностью антитромбина. [51] [53]
Его изучали при сепсисе для снижения диффузного внутрисосудистого свертывания крови и других исходов. Не было обнаружено никакой пользы от него у критически больных людей с сепсисом. [54]

Расщепление в реактивном сайте приводит к захвату протеазы тромбина с перемещением петли расщепленного реактивного сайта вместе со связанной протеазой, так что петля образует дополнительную шестую цепь в середине бета-листа А. Это перемещение реактивного сайта петлю также можно индуцировать без расщепления, при этом полученная кристаллографическая структура будет идентична структуре физиологически латентной конформации ингибитора активатора плазминогена-1 (PAI-1). [55] По этой причине конформация антитромбина, в которой петля реактивного сайта включена в нерасщепленную основную часть белка, называется латентным антитромбином. В отличие от PAI-1 переход антитромбина из нормальной или нативной конформации в латентную конформацию необратим.
Нативный антитромбин можно превратить в латентный антитромбин (L-антитромбин) путем нагревания отдельно или в присутствии цитрата . [56] [57] Однако без чрезмерного нагревания и при температуре 37 °C (температура тела) 10% всего антитромбина, циркулирующего в крови, превращается в L-антитромбин в течение 24 часов. [58] [59] Структура L-антитромбина показана на Фигуре 6 .
Трехмерная структура нативного антитромбина была впервые определена в 1994 году. [31] [32] Неожиданно белок кристаллизовался в виде гетеродимера , состоящего из одной молекулы нативного антитромбина и одной молекулы латентного антитромбина. Латентный антитромбин при образовании сразу же связывается с молекулой нативного антитромбина с образованием гетеродимера, и только когда концентрация латентного антитромбина превышает 50% от общего антитромбина, его можно обнаружить аналитически. [59] Латентная форма антитромбина не только неактивна в отношении целевых протеаз свертывания крови, но и ее димеризация с активной в других отношениях молекулой нативного антитромбина также приводит к инактивации нативных молекул. Физиологическое воздействие потери активности антитромбина либо через латентное образование антитромбина, либо через последующее образование димера усугубляется предпочтением возникновения димеризации между активированным гепарином β-антитромбином и латентным антитромбином в отличие от α-антитромбина. [59]
Также была выделена форма антитромбина, которая является промежуточным звеном в превращении нативной и латентной форм антитромбина, и ее назвали прелатентным антитромбином . [60]
Ангиогенез — это физиологический процесс, включающий рост новых кровеносных сосудов из ранее существовавших сосудов. В нормальных физиологических условиях ангиогенез жестко регулируется и контролируется балансом ангиогенных стимуляторов и ангиогенных ингибиторов . Рост опухоли зависит от ангиогенеза, и во время развития опухоли требуется устойчивая продукция ангиогенных стимулирующих факторов наряду со снижением количества ангиогенных ингибирующих факторов, продуцируемых опухолевыми клетками. [61] Расщепленная и латентная форма антитромбина мощно ингибируют ангиогенез и рост опухолей на животных моделях. [62] Было показано, что прелатентная форма антитромбина ингибирует ангиогенез in vitro , но на сегодняшний день не тестировалась на экспериментальных моделях животных.