Фибриноген ( фактор I ) представляет собой гликопротеиновый комплекс , вырабатываемый в печени [1] , который циркулирует в крови всех позвоночных животных . [2] При повреждении тканей и сосудов он ферментативно преобразуется тромбином в фибрин , а затем в сгусток крови на основе фибрина . Сгустки фибрина в первую очередь перекрывают кровеносные сосуды и останавливают кровотечение . Фибрин также связывает и снижает активность тромбина. Эта активность, иногда называемая антитромбином I , ограничивает свертывание крови. [1] Фибрин также опосредует распространение тромбоцитов и эндотелиальных клеток , пролиферацию тканевых фибробластов , образование капиллярных трубок и ангиогенез и тем самым способствует реваскуляризации и заживлению ран . [3]
Пониженный и/или дисфункциональный уровень фибриногена встречается при различных врожденных и приобретенных заболеваниях человека, связанных с фибриногеном . Эти расстройства представляют собой группу редких состояний, при которых у людей могут наблюдаться тяжелые эпизоды патологического кровотечения и тромбоза ; эти состояния лечатся путем повышения уровня фибриногена в крови и ингибирования свертывания крови соответственно. [4] [5] Эти расстройства также могут быть причиной некоторых заболеваний печени и почек. [1]
Фибриноген является «положительным» белком острой фазы , то есть его уровень в крови повышается в ответ на системное воспаление , повреждение тканей и некоторые другие события. Его уровень также повышается при различных видах рака . Было высказано предположение , что повышенные уровни фибриногена при воспалении , а также раке и других состояниях являются причиной тромбоза и повреждения сосудов, которые сопровождают эти состояния. [6] [7]
Фибриноген вырабатывается и секретируется в кровь преимущественно клетками гепатоцитов печени . Сообщается также, что клетки эндотелия производят небольшое количество фибриногена, но этот фибриноген полностью не охарактеризован; Тромбоциты и их предшественники, мегакариоциты костного мозга , хотя когда-то считалось, что они производят фибриноген, теперь известно, что они поглощают и хранят, но не производят гликопротеин. [4] [7] Последний секретируемый гликопротеин, полученный из гепатоцитов, состоит из двух тримеров , каждый из которых состоит из трех различных полипептидных цепей : альфа-цепи фибриногена (также называемой Aα или α-цепью), кодируемой геном FGA , бета-цепь фибриногена (также называемая цепью Bβ или β), кодируемая геном FGB , и гамма-цепь фибриногена (также называемая γ-цепью), кодируемая геном FGG . Все три гена расположены на длинном или «q» плече 4-й хромосомы человека (в позициях 4q31.3, 4q31.3 и 4q32.1 соответственно). [1]
Альтернативный сплайсинг гена FGA дает минорную расширенную изоформу Aα, называемую AαE, которая заменяет Aα в 1–3% циркулирующего фибриногена; альтернативный сплайсинг FGG дает минорную изоформу γ, называемую γ', которая заменяет γ в 8–10% циркулирующего фибриногена; FGB альтернативно не сращивается. Следовательно, конечный продукт фибриногена состоит в основном из цепей Aα, Bβ и γ, причем небольшой процент его содержит цепи AαE и/или γ' вместо цепей Aα и/или γ соответственно. Три гена координировано транскрибируются и транслируются с помощью механизма(ов), который остается не до конца понятным. [8] [9] [10] [11] [12] Скоординированная транскрипция этих трех генов фибриногена быстро и значительно увеличивается при системных состояниях, таких как воспаление и повреждение тканей. Цитокины, вырабатываемые при этих системных состояниях, такие как интерлейкин 6 и интерлейкин 1β , по-видимому, ответственны за активацию этой транскрипции. [11]

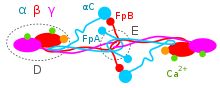

Цепи Aα, Bβ и γ координировано транскрибируются и транслируются в эндоплазматическом ретикулуме (ЭР), при этом их пептидные цепи передаются в ЭР, а их сигнальные пептидные части удаляются. Внутри ЭР три цепи сначала собираются в димеры Aαγ и Bβγ, затем в тримеры AαBβγ и, наконец, в гексимеры (AαBβγ) 2 , т.е. в два тримера AαBβγ, соединенные многочисленными дисульфидными связями . Гексимер переносится в аппарат Гольджи , где он гликозилируется , гидроксилируется , сульфатируется и фосфорилируется с образованием зрелого гликопротеина фибриногена, который секретируется в кровь. [10] [12] Зрелый фибриноген представляет собой длинный гибкий белковый массив из трех узелков, скрепленных вместе очень тонкой нитью, диаметр которой, по оценкам, составляет от 8 до 15 ангстрем (Å). Два концевых узелка (называемые D-областями или доменами) одинаково состоят из цепей Bβ и γ, тогда как центральный узелок немного меньшего размера (называемый областью или доменом E) состоит из двух переплетенных альфа-цепей Aα. Измерения длин теней показывают, что диаметр узелков находится в диапазоне от 50 до 70 Å. Длина высушенной молекулы составляет 475 ± 25 Å. [14]
Молекула фибриногена циркулирует как растворимый гликопротеин плазмы с типичной молекулярной массой ~340 – ~420 кДа (килодальтон) [15] (в зависимости от содержания в ней цепей Aα и AαE, γ и γ' и углеводов [~4 – ~ 10% по массе]). Он имеет стержнеобразную форму с размерами 9 × 47,5 × 6 нм и имеет отрицательный суммарный заряд при физиологическом pH (его изоэлектрическая точка ~5,5 – ~6,5, например pH 5,8 [16] [17] ). Нормальная концентрация фибриногена в плазме крови составляет 150–400 мг/дл, при этом уровни значительно ниже или выше этого диапазона связаны с патологическим кровотечением и/или тромбозом. Фибриноген имеет период полураспада из циркуляции ~4 дня. [12]
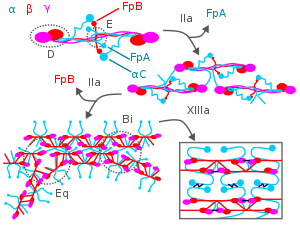
Во время свертывания крови тромбин атакует N-конец цепей Aα и Bβ фибриногена, образуя отдельные нити фибрина плюс два небольших полипептида , фибринопептиды A и B , полученные из этих соответствующих цепей. Отдельные нити фибрина затем полимеризуются и сшиваются с другими нитями фибрина под действием фактора XIIIa крови , образуя обширную взаимосвязанную фибриновую сеть, которая является основой для формирования зрелого фибринового сгустка. [3] [7] [18] Помимо образования фибрина, фибриноген также способствует свертыванию крови, образуя мостики между тромбоцитами и активируя их посредством связывания с их рецептором фибриногена на поверхности мембраны GpIIb/IIIa . [18]
Фибрин участвует в ограничении образования тромбов и разрушении образовавшихся тромбов по крайней мере двумя важными механизмами. Во-первых, он обладает тремя сайтами связывания с низким сродством (два в E-домене фибрина и один в его D-домене) для тромбина; это связывание изолирует тромбин от воздействия на фибриноген. [18] Во-вторых, Аα-цепь фибрина ускоряет по меньшей мере в 100 раз количество плазмина , активированного тканевым активатором плазминогена ; плазмин разрушает тромбы. [5] [18] [3] [7] Атака плазмина на фибрин приводит к высвобождению D-димеров (также называемых DD-димерами). Обнаружение этих димеров в крови используется в качестве клинического теста на фибринолиз. [5]
Некоторые нарушения количества и/или качества фибриногена вызывают патологическое кровотечение, патологическое свертывание крови и/или отложение фибриногена в печени, почках и других тканях.
Врожденная афибриногенемия — редкое и, как правило, аутосомно-рецессивное наследственное заболевание, при котором кровь не свертывается из-за недостатка фибриногена (обычно уровень фибриногена в плазме), но иногда обнаруживается на чрезвычайно низких уровнях, например <10 мг/дл. Это тяжелое заболевание обычно вызвано мутациями как в материнской, так и в отцовской копиях гена FGA, FGB или FBG . Мутации обладают практически полной генетической пенетрантностью , при этом практически у всех гомозиготных носителей наблюдаются частые, а иногда и опасные для жизни эпизоды кровотечений и/или тромбозов. Патологическое кровотечение возникает в раннем возрасте, например, часто наблюдается при рождении с чрезмерным кровотечением из пупка . [4]
Врожденная гипофибриногенемия — редкое наследственное заболевание, при котором кровь не может нормально свертываться из-за снижения уровня фибриногена (фибриноген в плазме обычно <150, но >50 мг/дл). Заболевание отражает деструктивную мутацию только в одном из двух родительских генов FGA, FGB или FBG и имеет низкую степень генетической пенетрантности, т.е. только у некоторых членов семьи с дефектным геном когда-либо проявляются симптомы. Симптомы заболевания, которое чаще возникает у лиц с более низким уровнем фибриногена в плазме, включают эпизодические кровотечения и тромбозы, которые обычно начинаются в позднем детстве или в зрелом возрасте. [4]
Болезнь накопления фибрингогена – чрезвычайно редкое заболевание. Это форма врожденной гипофибриногенемии, при которой определенные наследственные мутации в одной копии гена FGG вызывают накопление его продукта фибриногена в клетках печени и их повреждение. Заболевание не сопровождалось мутациями FGA или FGB . Симптомы этих мутаций FGG имеют низкий уровень пенетрантности. Уровни фибриногена в плазме (обычно <150, но >50 мг/дл), обнаруженные при этом заболевании, отражают фибриноген, вырабатываемый нормальным геном. Болезнь накопления фибриногена может привести к аномальному кровотечению и тромбозу, но иногда приводит к циррозу печени . [19]
Врожденная дисфибриногенемия — это редкое аутосомно-доминантное наследственное заболевание, при котором фибриноген плазмы состоит из дисфункционального фибриногена, образованного мутированным геном FGA, FGB или FBG , унаследованного от одного родителя, плюс нормальный фибриноген, образованный нормальным геном, унаследованным от другого родителя. Как отражение этой двойственности, уровни фибриногена в плазме, измеренные иммунологическими методами, являются нормальными (>150 мг/дл), но составляют c. На 50% ниже при измерении методами образования тромбов. Заболевание имеет пониженную пенетрантность , и только у некоторых людей с аномальным геном проявляются симптомы аномального кровотечения и тромбоза. [20]
Наследственный фибриногенный Аα-цепочечный амилоидоз — крайне редкое наследственное заболевание, передающееся по аутосомно-доминантному типу и обусловленное мутацией в одной из двух копий гена FGA . Это форма врожденной дисфибриногенемии, при которой определенные мутации приводят к выработке аномального фибриногена, который циркулирует в крови и постепенно накапливается в почках. Такое накопление со временем приводит к одной из форм семейного амилоидоза почек . Уровни фибриногена в плазме аналогичны тем, которые наблюдаются при других формах врожденной дисфибриногенемии. Фибриногеновый амилоидоз Аα-цепи не связан с аномальным кровотечением или тромбозом. [21]
Приобретенная дисфибриногенемия — редкое заболевание, при котором циркулирующий фибриноген состоит, по крайней мере частично, из дисфункционального фибриногена, вызванного различными приобретенными заболеваниями. Одной из хорошо изученных причин этого расстройства является тяжелое заболевание печени , включая гепатому , хронический активный гепатит , цирроз печени и желтуху вследствие обструкции желчевыводящих путей . Больная печень синтезирует фибриноген, который имеет нормально функциональную аминокислотную последовательность, но неправильно гликозилирован (т.е. имеет неправильное количество остатков сахара), добавляемый к нему во время прохождения через аппарат Гольджи. Неправильно гликозированный фибриноген является дисфункциональным и может вызывать патологические эпизоды кровотечения и/или свертывания крови. Другими, менее изученными причинами являются дискразии плазматических клеток и аутоиммунные заболевания , при которых циркулирующий аномальный иммуноглобулин или другой белок нарушает функцию фибриногена, а также редкие случаи рака и токсичности лекарств ( изотретиноин , глюкокортикоиды и противолейкемические препараты ). [18]
Врожденная гиподисфибриногенемия — редкое наследственное заболевание, при котором низкие уровни (т.е. <150 мг/дл) иммунологически определяемого фибриногена плазмы состоят, по крайней мере, частично из дисфункционального фибриногена. Заболевание обычно отражает мутации в обоих наследственных генах фибриногена, один из которых продуцирует дисфункциональный фибриноген, а другой производит небольшое количество фибриногена. Заболевание, хотя и имеет пониженную пенетрантность , обычно протекает более тяжело, чем врожденная дисфибриногенемия, но, как и последнее заболевание, вызывает патологические эпизоды кровотечения и/или свертывания крови. [22]
Криофибриногенемия — приобретенное заболевание, при котором фибриноген осаждается при низких температурах и может привести к внутрисосудистому осаждению фибриногена, фибрина и других циркулирующих белков, тем самым вызывая инфаркт различных тканей и конечностей. Криоглобулонемия может возникать без признаков основного сопутствующего заболевания, т. е. первичной криоглобулинемии (также называемой эссенциальной криоглобулинемией), или, что гораздо чаще, при наличии признаков основного заболевания, т. е. вторичной криоглобулонемии. Вторичная криофибринонемия может развиваться у лиц с инфекцией ( около 12 % случаев), злокачественными или предраковыми заболеваниями (21 %), васкулитами (25 %) и аутоиммунными заболеваниями (42 %). В этих случаях криофибиногенема может вызывать или не вызывать повреждение тканей и/или другие симптомы, а фактическая причинно-следственная связь между этими заболеваниями и развитием криофибриногенемии неясна. Криофибриногенемия также может возникать в связи с приемом некоторых лекарств. [23] [24] [25] [26]
Приобретенная гипофибриногенемия — дефицит циркулирующего фибриногена вследствие его чрезмерного потребления, который может возникнуть в результате травмы , определенных фаз диссеминированного внутрисосудистого свертывания крови и сепсиса . Это также может произойти в результате гемодилюции в результате кровопотери и/или переливания эритроцитов или других заменителей цельной крови с низким содержанием фибриногена. [27]
Клинический анализ нарушений фибриногена обычно измеряет свертываемость крови, используя следующие последовательные этапы: [28] Более высокие уровни, среди прочего, связаны с сердечно-сосудистыми заболеваниями (>3,43 г/л). [ необходимы разъяснения ] Его уровень может повышаться при любой форме воспаления , поскольку это белок острой фазы ; например, это особенно заметно в тканях десен человека на начальной стадии заболеваний пародонта . [29] [30]
Уровни функционально нормального фибриногена повышаются во время беременности в среднем до 4,5 грамм/литр (г/л) по сравнению со средним показателем 3 г/л у небеременных людей. Они также могут увеличиваться при различных формах рака, особенно при раке желудка , легких , простаты и яичников . В этих случаях гиперфибриногенемия может способствовать развитию патологического тромбоза. Особая картина мигрирующего тромбоза поверхностных вен , называемая синдромом Труссо , возникает при всех других признаках и симптомах этих видов рака и может предшествовать им. [7] [32] Гиперфибриногенемия также считается причиной стойкой легочной гипертензии у новорожденных [33] и послеоперационного тромбоза. [34] Высокие уровни фибриногена были предложены в качестве предиктора геморрагических осложнений во время катетер-направленного тромболизиса при острой или подострой окклюзии периферической нативной артерии и артериального шунтирования. [35] Однако систематический обзор доступной литературы до января 2016 года показал, что прогностическая ценность уровня фибриногена в плазме для прогнозирования геморрагических осложнений после катетер-направленного тромболизиса не доказана. [36]
Пол Моравиц в 1905 году описал фибриноген. [37]