Синдром Коккейна ( CS ), также называемый синдромом Нила-Дингуолла , является редким и фатальным аутосомно- рецессивным нейродегенеративным заболеванием, характеризующимся задержкой роста, нарушением развития нервной системы , аномальной чувствительностью к солнечному свету ( фотосенсибилизацией ), заболеваниями глаз и преждевременным старением . [1] [2] [3] Критериями диагностики являются задержка развития и неврологические расстройства, в то время как фотосенсибилизация, потеря слуха, аномалии глаз и полости являются другими очень распространенными признаками. [3] Возможны проблемы с любым или всеми внутренними органами. Он связан с группой расстройств, называемых лейкодистрофиями , которые представляют собой состояния, характеризующиеся деградацией неврологического белого вещества . Существует два основных типа синдрома Коккейна: синдром Коккейна типа A (CSA) , возникающий из-за мутаций в гене ERCC8 , и синдром Коккейна типа B (CSB) , возникающий из-за мутаций в гене ERCC6 . [4]
Основополагающее расстройство — дефект в механизме восстановления ДНК . [5] В отличие от других дефектов восстановления ДНК, пациенты с синдромом Коккейна не предрасположены к раку или инфекции. [6] Синдром Коккейна — редкое, но разрушительное заболевание, обычно приводящее к смерти в течение первого или второго десятилетия жизни. Мутация определенных генов при синдроме Коккейна известна, но широко распространенные эффекты и их связь с восстановлением ДНК еще не изучены. [6]
Он назван в честь английского врача Эдварда Альфреда Коккейна (1880–1956), который впервые описал его в 1936 году и повторно описал в 1946 году. [7] Синдром Нила-Дингвалла был назван в честь Мэри М. Дингуолл и Кэтрин А. Нилл. [7] Эти два ученых описали случай двух братьев с синдромом Коккейна и утверждали, что это было то же самое заболевание, которое описал Коккейн. В своей статье они внесли вклад в признаки заболевания, открыв кальцификации в мозге. Они также сравнили синдром Коккейна с тем, что сейчас известно как синдром прогерии Хатчинсона-Гилфорда (HGPS), тогда называвшийся прогерией из-за замедленного старения, которое характерно для обоих расстройств. [7]
Если в организме возникает гипероксия или избыток кислорода , клеточный метаболизм производит несколько высокореактивных форм кислорода, называемых свободными радикалами . Это может вызвать окислительное повреждение клеточных компонентов, включая ДНК . В нормальных клетках наш организм восстанавливает поврежденные участки. В случае этого заболевания из-за тонких дефектов транскрипции генетический аппарат детей для синтеза белков, необходимых организму, не работает в нормальном режиме. Со временем, согласно этой теории, это приводит к нарушению развития и смерти. Каждую минуту организм перекачивает от 10 до 20 литров кислорода через кровь , доставляя его к миллиардам клеток нашего тела. В своей нормальной молекулярной форме кислород безвреден. Однако клеточный метаболизм с участием кислорода может генерировать несколько высокореактивных свободных радикалов. Эти свободные радикалы могут вызвать окислительное повреждение клеточных компонентов, включая ДНК. В средней человеческой клетке ежедневно в ДНК происходит несколько тысяч повреждений . Многие из этих повреждений являются результатом окислительного повреждения . Каждое повреждение — поврежденный участок ДНК — должно быть вырезано, а ДНК восстановлена, чтобы сохранить ее нормальную функцию. Невосстановленная ДНК может потерять способность кодировать белки. Также могут возникнуть мутации. Эти мутации могут активировать онкогены или подавлять гены-супрессоры опухолей. Согласно исследованиям, окислительное повреждение активных генов не восстанавливается в первую очередь, а в самых тяжелых случаях восстановление замедляется по всему геному . Возникающее в результате накопление окислительного повреждения может нарушить нормальные функции ДНК и даже может привести к запуску программы гибели клеток (апоптоза). Дети с этим заболеванием не восстанавливают активные гены, где происходит окислительное повреждение. Обычно восстановление окислительного повреждения происходит быстрее в активных генах (которые составляют менее пяти процентов генома), чем в неактивных областях ДНК. Возникающее в результате накопление окислительного повреждения может нарушить нормальные функции ДНК и даже может привести к запуску программы гибели клеток ( апоптоза ). [12]
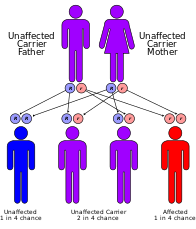
Синдром Коккейна генетически классифицируется следующим образом: [13]
В отличие от клеток с нормальной способностью к репарации, клетки с дефицитом CSA и CSB не способны преимущественно восстанавливать циклобутановые пиримидиновые димеры, индуцированные действием ультрафиолетового (УФ) света на матричную цепь активно транскрибируемых генов . [14] Этот дефицит отражает потерю способности выполнять процесс репарации ДНК, известный как транскрипционно-связанная эксцизионная репарация нуклеотидов (TC-NER). [15]
Внутри поврежденной клетки белок CSA обычно локализуется в местах повреждения ДНК , в частности, в межцепочечных сшивках, двухцепочечных разрывах и некоторых моноаддуктах. [16] Белок CSB также обычно рекрутируется в поврежденные участки ДНК, и его рекрутирование происходит наиболее быстро и надежно следующим образом: межцепочечные сшивки > двухцепочечные разрывы > моноаддукты > окислительное повреждение. [16] Белок CSB образует комплекс с другим белком репарации ДНК, SNM1A ( DCLRE1A ), 5'-3' экзонуклеазой , которая локализуется в межцепочечных сшивках транскрипционно-зависимым образом. [17] Накопление белка CSB в местах двухцепочечных разрывов ДНК происходит транскрипционно-зависимым образом и облегчает гомологичную рекомбинационную репарацию разрывов. [18] Во время фазы G0 / G1 клеточного цикла повреждение ДНК может запустить CSB-зависимый рекомбинационный процесс восстановления, который использует шаблон РНК (а не ДНК ). [19]
Преждевременные признаки старения при синдроме Корнелиса, вероятно, обусловлены, по крайней мере частично, недостатками в восстановлении ДНК (см. теорию повреждения ДНК при старении ). [15]
Люди с этим синдромом имеют меньшие, чем обычно, размеры головы ( микроцефалия ), низкий рост ( карликовость ), их глаза кажутся запавшими, и они выглядят «старыми». У них часто длинные конечности с контрактурами суставов (неспособность расслабить мышцу в суставе), сгорбленная спина ( кифоз ), и они могут быть очень худыми ( кахетичными ) из-за потери подкожного жира. Их маленький подбородок, большие уши и заостренный, тонкий нос часто придают им старческий вид. [9] Кожа людей с синдромом Коккейна также часто поражается: гиперпигментация, варикозное расширение вен или сосудистые звездочки ( телеангиэктазия ), [9] и серьезная чувствительность к солнечному свету являются обычным явлением, даже у людей без XP-CS. Часто у пациентов с синдромом Коккейна наблюдаются сильные ожоги или волдыри при очень небольшом воздействии тепла. Глаза пациентов могут быть поражены по-разному, и глазные аномалии являются обычным явлением при CS. Катаракта и помутнение роговицы ( помутнение роговицы ) являются обычным явлением. Может произойти потеря и повреждение нервов зрительного нерва, вызывающее атрофию зрительного нерва. [3] Нистагм или непроизвольное движение глаз, и зрачки, которые не расширяются, демонстрируют потерю контроля над произвольным и непроизвольным движением мышц. [9] Пигментация сетчатки в виде соли и перца также является типичным признаком. Диагноз устанавливается с помощью специального теста на репарацию ДНК, который измеряет восстановление РНК после воздействия УФ-излучения. Несмотря на то, что CS связан с генами, участвующими в репарации нуклеотидов (NER), в отличие от пигментной ксеродермы , CS не связан с повышенным риском рака. [6]
У пациентов с синдромом Коккейна клетки, облученные УФ-излучением, демонстрируют снижение синтеза ДНК и РНК. https://emedicine.medscape.com/article/1115866-workup#c5 Лабораторные исследования в основном полезны для исключения других расстройств. Например, рентгенография скелета, эндокринологические тесты и исследования хромосомных разрывов могут помочь в исключении расстройств, включенных в дифференциальную диагностику. [ необходима цитата ]
КТ головного мозга у пациентов с синдромом Коккейна может выявить кальцификацию и атрофию коры головного мозга. [15]
Возможна пренатальная оценка. Культивирование клеток амниотической жидкости используется для демонстрации того, что фетальные клетки имеют дефицит синтеза РНК после УФ-облучения. [ необходима цитата ]
Исследования с помощью визуализации показывают широко распространенное отсутствие миелиновых оболочек нейронов в белом веществе мозга и общую атрофию коры. [6] Кальцификаты также были обнаружены в скорлупе , области переднего мозга , которая регулирует движения и помогает в некоторых формах обучения, [9] наряду с корой. [7] Кроме того, атрофия центральной области мозжечка , обнаруженная у пациентов с синдромом Коккейна, также может привести к отсутствию мышечного контроля, особенно непроизвольного, и плохой осанке, которая обычно наблюдается. [ необходима цитата ]
Не существует постоянного лечения этого синдрома, хотя пациентов можно лечить симптоматически. Лечение обычно включает физиотерапию и небольшие операции на пораженных органах, такие как удаление катаракты. [3] Также рекомендуется носить солнцезащитный крем с высоким фактором защиты и защитную одежду, поскольку пациенты с синдромом Коккейна очень чувствительны к УФ-излучению. [20] Оптимальное питание также может помочь. Рекомендуется генетическое консультирование для родителей, поскольку это расстройство имеет 25% вероятность передачи любым будущим детям, а также возможно пренатальное тестирование. [3] Другим важным аспектом является профилактика рецидива синдрома Коккейна у других братьев и сестер. Выявление вовлеченных дефектов генов позволяет предлагать генетическое консультирование и пренатальное диагностическое тестирование родителям, у которых уже есть один пораженный ребенок. [21]
В настоящее время существуют два текущих проекта, направленных на разработку генной терапии для синдрома Коккейна. Первый проект, возглавляемый Ассоциацией детей с редкими заболеваниями Вильджема Джулиджана, направлен на разработку генной терапии специально для синдрома Коккейна типа B. [22] Второй проект, возглавляемый Исследовательской инициативой Риана, посвящен разработке генной терапии для синдрома Коккейна типа A. [23]
Прогноз для людей с синдромом Коккейна неблагоприятный, так как смерть обычно наступает к 12 годам. [24] Прогноз для синдрома Коккейна варьируется в зависимости от типа заболевания. Существует три типа синдрома Коккейна в зависимости от тяжести и начала симптомов. Однако различия между типами не всегда четкие, и некоторые исследователи полагают, что признаки и симптомы отражают спектр, а не отдельные типы: Синдром Коккейна типа А (CSA) характеризуется нормальным развитием до тех пор, пока ребенку не исполнится 1 или 2 года, после чего рост замедляется и отмечаются задержки развития. Симптомы не проявляются до достижения ребенком 1 года. Ожидаемая продолжительность жизни для типа А составляет приблизительно 10–20 лет. Эти симптомы наблюдаются у детей с CS типа 1. Синдром Коккейна типа B (CSB), также известный как «синдром церебро-окуло-фацио-скелетный (COFS)» (или «синдром Пена-Шокейра типа B»), является наиболее тяжелым подтипом. Симптомы присутствуют при рождении, и нормальное развитие мозга прекращается после рождения. Средняя продолжительность жизни детей с типом B составляет до 7 лет. Эти симптомы наблюдаются у детей с CS типа 2. Синдром Коккейна типа C (CSC) проявляется позже в детстве с более мягкими симптомами, чем у других типов, и более медленным прогрессированием расстройства. Люди с этим типом синдрома Коккейна доживают до взрослого возраста, средняя продолжительность жизни составляет от 40 до 50 лет. Эти симптомы наблюдаются при CS типа 3. [15]
Синдром Коккейна встречается редко во всем мире. Расовой предрасположенности к синдрому Коккейна не описано. Половой предрасположенности к синдрому Коккейна не описано; соотношение мужчин и женщин одинаковое. Синдром Коккейна I (CS-A) проявляется в детстве. Синдром Коккейна II (CS-B) проявляется при рождении или в младенчестве и имеет худший прогноз. [15]
В недавнем исследовании, проведенном в январе 2018 года, упоминаются различные особенности КС, наблюдаемые во всем мире, имеющие как сходства, так и различия: заболеваемость КС составляет 1 на 250 000 живорождений, а распространенность составляет приблизительно 1 на 2,5 миллиона, что на удивление единообразно в различных регионах мира: [25] [26]