Cre-рекомбиназа представляет собой фермент тирозинрекомбиназу, полученный из бактериофага P1 . Фермент использует механизм, подобный топоизомеразе I , для осуществления событий сайт-специфической рекомбинации . Фермент (38 кДа) является членом семейства интегразных сайт-специфических рекомбиназ, и известно, что он катализирует событие сайт-специфической рекомбинации между двумя сайтами узнавания ДНК ( сайты LoxP ). Этот сайт узнавания loxP длиной 34 пары оснований (bp) состоит из двух палиндромных последовательностей длиной 13 bp , которые фланкируют спейсерную область длиной 8 bp. Продукты Cre-опосредованной рекомбинации по сайтам loxP зависят от местоположения и относительной ориентации сайтов loxP. Два отдельных вида ДНК, оба содержащие сайты loxP, могут подвергаться слиянию в результате рекомбинации, опосредованной Cre. Последовательности ДНК, обнаруженные между двумя сайтами loxP, называются « флоксированными ». В этом случае продукты рекомбинации, опосредованной Cre, зависят от ориентации сайтов loxP. ДНК, обнаруженная между двумя сайтами loxP, ориентированными в одном направлении, будет вырезана в виде кольцевой петли ДНК, в то время как промежуточная ДНК между двумя сайтами loxP, ориентированными в противоположном направлении, будет инвертирована. [1] Для своей функции фермент не требует дополнительных кофакторов (таких как АТФ ) или вспомогательных белков. [2]
Фермент играет важную роль в жизненном цикле бактериофага P1, например, в циклизации линейного генома и разрешении димерных хромосом , образующихся после репликации ДНК . [3]
Рекомбиназа Cre — широко используемый инструмент в области молекулярной биологии . Уникальная и специфическая система рекомбинации фермента используется для манипулирования генами и хромосомами в огромном диапазоне исследований, таких как нокаут генов или нокаут в исследованиях. Способность фермента эффективно работать в широком диапазоне клеточных сред (включая млекопитающих, растения, бактерии и дрожжи) позволяет использовать систему рекомбинации Cre-Lox в огромном количестве организмов, что делает ее особенно полезным инструментом в научных исследованиях. . [4]
Исследования, проведенные в 1981 году Штернбергом и Гамильтоном, показали, что бактериофаг P1 обладает уникальной системой сайт-специфической рекомбинации. EcoRI- фрагменты генома бактериофага P1 были созданы и клонированы в лямбда-векторы . Было обнаружено, что фрагмент EcoRI размером 6,5 т.п.н. (фрагмент 7) обеспечивает эффективные события рекомбинации. [5] Известно, что механизм этих событий рекомбинации уникален, поскольку они происходят в отсутствие бактериальных белков RecA и RecBCD . Компоненты этой рекомбинационной системы были выяснены с помощью исследований делеционного мутагенеза . Эти исследования показали, что для возникновения эффективных событий рекомбинации необходимы как продукт гена P1, так и сайт рекомбинации. Продукт гена P1 был назван Cre ( вызывает рекомбинацию ) , а сайт рекомбинации был назван loxP ( локус кроссингинга ( x )over, P -1). [5] Белок Cre был очищен в 1983 году и оказался белком массой 35 000 Да. [2] Для рекомбиназной активности очищенного белка не требуются высокоэнергетические кофакторы, такие как АТФ или вспомогательные белки. [2] Ранние исследования также показали, что Cre связывается с неспецифическими последовательностями ДНК, обладая при этом в 20 раз более высоким сродством к последовательностям loxP, а результаты ранних исследований ДНК-следов также показали, что молекулы Cre связывают сайты loxP в виде димеров . [2]
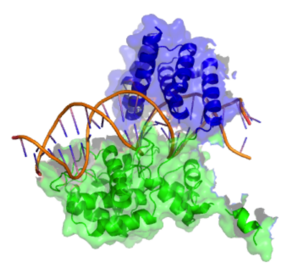

Рекомбиназа Cre состоит из 343 аминокислот , которые образуют два отдельных домена. Аминоконцевой домен включает остатки 20–129 и содержит 5 альфа-спиральных сегментов , связанных серией коротких петель. Спирали A и E участвуют в образовании тетрамера рекомбиназы, причем C-концевая область спирали E, как известно, образует контакты с C-концевым доменом соседних субъединиц. Спирали B и D образуют прямые контакты с большой бороздкой ДНК loxP. Считается, что эти две спирали осуществляют три прямых контакта с основаниями ДНК в сайте loxP. Карбокси -концевой домен фермента состоит из аминокислот 132–341 и содержит активный центр фермента. Общая структура этого домена имеет большое структурное сходство с каталитическим доменом других ферментов того же семейства, таких как интеграза λ и интеграза HP1. Этот домен имеет преимущественно спиральную структуру с 9 отдельными спиралями (F-N). Концевая спираль (N) выступает из основной части карбокси-домена, и считается, что эта спираль играет роль в обеспечении взаимодействий с другими субъединицами. Кристаллические структуры демонстрируют, что эта концевая N-спираль зарывает свою гидрофобную поверхность в акцепторный карман соседней субъединицы Cre. [6]
Эффект двухдоменной структуры заключается в формировании С-образного зажима, захватывающего ДНК с противоположных сторон. [3]

Активный центр фермента Cre состоит из консервативных каталитических остатков триады Arg 173, His 289, Arg 292, а также консервативных нуклеофильных остатков Tyr 324 и Trp 315. В отличие от некоторых ферментов рекомбиназы, таких как рекомбиназа Flp, Cre не образует активный центр между отдельными субъединицами, и все остатки, входящие в активный центр, находятся на одной субъединице. Следовательно, когда две молекулы Cre связываются в одном сайте loxP, присутствуют два активных центра. Рекомбинация, опосредованная Cre, требует образования синапса, в котором два комплекса Cre-LoxP соединяются с образованием так называемого тетрамера синапса, в котором присутствуют 4 различных активных центра. [6] Tyr 324 действует как нуклеофил , образуя ковалентную 3'-фосфотирозиновую связь с ДНК-субстратом. Разделяющийся фосфат (фосфат , нацеленный на нуклеофильную атаку в сайте расщепления) координируется боковыми цепями трех аминокислотных остатков каталитической триады ( Arg 173, His 289 и Trp 315). Индольный азот триптофана 315 также образует водородную связь с этим разрезаемым фосфатом . (Примечание: Гистидин А занимает этот сайт у других членов семейства тирозинрекомбиназ и выполняет ту же функцию). Эта реакция расщепляет ДНК и освобождает 5'-гидроксильную группу. Этот процесс происходит в активном центре двух из четырех субъединиц рекомбиназы, присутствующих в тетрамере синапса. Если 5'-гидроксильные группы атакуют 3'-фосфотирозиновую связь, одна пара нитей ДНК поменяется с образованием промежуточного соединения Холлидея . [3]
Рекомбиназа Cre играет важную роль в жизненном цикле бактериофага P1 . При инфицировании клетки система Cre-loxP используется для того, чтобы вызвать циркуляризацию ДНК P1. В дополнение к этому Cre также используется для разделения димерной лизогенной ДНК P1, которая образуется во время клеточного деления фага. [7]
Индуцируемая активация Cre достигается с использованием варианта CreER (рецептора эстрогена), который активируется только после введения тамоксифена . [8] Это достигается путем слияния мутированного лиганд-связывающего домена рецептора эстрогена с рекомбиназой Cre, в результате чего Cre специфически активируется тамоксифеном. В отсутствие тамоксифена CreER приведет к перемещению мутантной рекомбиназы в цитоплазму. Белок будет оставаться в этом месте в инактивированном состоянии до тех пор, пока не будет введен тамоксифен. После введения тамоксифена он метаболизируется в 4-гидрокситамоксифен, который затем связывается с ЭР и приводит к транслокации CreER в ядро, где он затем способен расщеплять lox-сайты. [9] Важно отметить, что иногда флуоресцентные репортеры могут активироваться в отсутствие тамоксифена из-за утечки нескольких молекул рекомбиназы Cre в ядро, что в сочетании с очень чувствительными репортерами приводит к непреднамеренному мечению клеток. [10] CreER(T2) был разработан для минимизации тамоксифен-независимой рекомбинации и максимизации чувствительности к тамоксифену.
В последние годы рекомбиназа Cre была улучшена за счет преобразования в предпочтительные кодоны млекопитающих , удаления известных загадочных сайтов сплайсинга , изменения стоп-кодона и снижения содержания CpG для снижения риска эпигенетического молчания у млекопитающих . [11] Также был идентифицирован ряд мутантов с повышенной точностью. [12]