
В органической химии краун -эфиры представляют собой циклические химические соединения , состоящие из кольца , содержащего несколько эфирных групп ( R−O−R' ). Наиболее распространенные краун-эфиры представляют собой циклические олигомеры этиленоксида , повторяющейся единицей которых является этиленокси, т. е. −CH 2 CH 2 O− . Важными членами этого ряда являются тетрамер ( n = 4), пентамер ( n = 5) и гексамер ( n = 6). Термин «краун» относится к сходству между структурой краун-эфира, связанного с катионом , и короной, сидящей на голове человека. Первая цифра в названии краун-эфира относится к числу атомов в цикле, а вторая цифра относится к числу тех атомов, которые являются кислородом . Краун-эфиры гораздо шире олигомеров этиленоксида ; важная группа получена из катехола .
Краун-эфиры прочно связывают определенные катионы, образуя комплексы . Атомы кислорода хорошо расположены для координации с катионом, расположенным внутри кольца, тогда как внешняя часть кольца гидрофобна. Образующиеся катионы часто образуют соли, растворимые в неполярных растворителях, и по этой причине краун-эфиры полезны в катализе фазового переноса . Дендантность полиэфира влияет на сродство краун-эфира к различным катионам. Например, 18-краун-6 имеет высокое сродство к катиону калия, 15-краун-5 — к катиону натрия, а 12-краун-4 — к катиону лития. Высокое сродство 18-краун-6 к ионам калия способствует его токсичности. Наименьший краун-эфир, все еще способный связывать катионы, — это 8-краун-4, [1] а наибольший экспериментально подтвержденный краун-эфир — 81-краун-27. [2] Краун-эфиры — не единственные макроциклические лиганды, имеющие сродство к катиону калия. Ионофоры , такие как валиномицин, также демонстрируют заметное предпочтение катиону калия по сравнению с другими катионами.
Было показано, что краун-эфиры координируются с кислотами Льюиса посредством электростатических взаимодействий типа σ-дырка (см. галогенная связь ) между основными атомами кислорода Льюиса краун-эфира и электрофильным центром кислоты Льюиса. [3] [4]
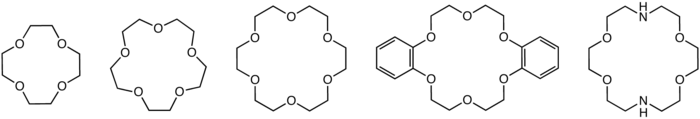
В 1967 году Чарльз Педерсен , химик, работавший в компании DuPont , открыл простой метод синтеза краун-эфира, когда пытался приготовить комплексообразующий агент для двухвалентных катионов. [5] [6] Его стратегия заключалась в связывании двух катехолатных групп через один гидроксил на каждой молекуле. Это связывание определяет полидентатный лиганд, который мог частично окутывать катион и, путем ионизации фенольных гидроксилов, нейтрализовать связанный дикатион. Он был удивлен, выделив побочный продукт , который сильно комплексовал катионы калия . Ссылаясь на более ранние работы по растворению калия в 16-краун-4, [7] [8] он понял, что циклические полиэфиры представляют собой новый класс комплексообразователей, которые способны связывать катионы щелочных металлов . Он продолжил сообщать о систематических исследованиях синтеза и связывающих свойств краун-эфиров в основополагающей серии статей. Области органического синтеза , катализаторы фазового переноса и другие новые дисциплины извлекли выгоду из открытия краун-эфиров. Педерсен особенно популяризировал дибензокраун-эфиры. [9]
Педерсен разделил Нобелевскую премию по химии 1987 года за открытие путей синтеза и связывающих свойств краун-эфиров.
Благодаря хелатному эффекту и макроциклическому эффекту краун-эфиры проявляют более сильное сродство к различным катионам, чем их разделенные или ациклические аналоги. При этом селективность катионов для ионов щелочных металлов в основном зависит от размера и плотности заряда иона, а также размера полости краун-эфира. [10]
Сродство данного краун-эфира к катионам лития , натрия и калия может изменяться на несколько величин, что объясняется большими различиями в их плотности заряда. Между катионами калия, рубидия и цезия изменения в сродстве менее заметны, поскольку их плотность заряда изменяется меньше, чем у щелочных металлов в более ранние периоды. [10]
Помимо высокого сродства к катионам калия, 18-краун-6 может также связываться с протонированными аминами и образовывать очень стабильные комплексы как в растворе, так и в газовой фазе. Некоторые аминокислоты , такие как лизин , содержат первичный амин на своих боковых цепях. Эти протонированные аминогруппы могут связываться с полостью 18-краун-6 и образовывать стабильные комплексы в газовой фазе. Водородные связи образуются между тремя атомами водорода протонированных аминов и тремя атомами кислорода 18-краун-6. Эти водородные связи делают комплекс стабильным аддуктом. Благодаря включению люминесцентных заместителей в их основную цепь, эти соединения оказались чувствительными ионными зондами, поскольку изменения в поглощении или флуоресценции фотоактивных групп можно измерить для очень низких концентраций присутствующего металла. [14] Некоторые привлекательные примеры включают макроциклы, включающие доноров кислорода и/или азота, которые присоединены к полиароматическим видам, таким как антрацены (через 9 и/или 10 позиции) [15] или нафталины (через 2 и 3 позиции). [16] Некоторые модификации ионофоров красителей краун-эфирами демонстрируют коэффициенты экстинкции , которые зависят от длины цепи цепочечных катионов. [17]