
Рибозим молотоголовый — это мотив РНК , который катализирует обратимые реакции расщепления и лигирования в определенном месте молекулы РНК. Это один из нескольких каталитических РНК ( рибозимов ), которые, как известно, встречаются в природе. Он служит модельной системой для исследования структуры и свойств РНК и используется для экспериментов по целевому расщеплению РНК, некоторые из которых предполагают терапевтическое применение. Названные за сходство ранних вторичных структурных диаграмм с акулой-молотом , [1] рибозимы молотоголовые были первоначально обнаружены в двух классах РНК, подобных вирусам растений: сателлитных РНК и вироидах . Они также известны в некоторых классах ретротранспозонов , включая ретрозимы . [2] Мотив рибозима молотоголовый повсеместно сообщался в линиях по всему древу жизни. [3] [4]
Реакции саморасщепления, впервые описанные в 1986 году, [5] [6] являются частью механизма репликации по принципу катящегося круга . Последовательность «головки молотка» достаточна для саморасщепления [7] и действует путем формирования консервативной трехмерной третичной структуры.
В своем естественном состоянии мотив РНК-молотка представляет собой одну нить РНК. Хотя расщепление происходит в отсутствие белковых ферментов , сама РНК-молотка в естественном состоянии не является катализатором , поскольку она расходуется в реакции (т.е. осуществляет саморасщепление) и, следовательно, не может катализировать множественные обороты.
Транс-действующие конструкции молоткообразной головки могут быть сконструированы таким образом, что они будут состоять из двух взаимодействующих цепей РНК, при этом одна цепь составляет молоткообразный рибозим, который расщепляет другую цепь. [8] [ требуется цитирование ] Цепь, которая расщепляется, может быть предоставлена в избытке, и может быть продемонстрировано и показано, что множественный оборот подчиняется кинетике Михаэлиса-Ментен , [8] [ требуется цитирование ] типичной для кинетики белковых ферментов . Такие конструкции обычно используются для экспериментов in vitro , и термин «молотообразная РНК» стал на практике синонимом более часто используемого «молотообразного рибозима ».
Минимальная транс-действующая последовательность рибозима молоткообразной головки, которая является каталитически активной, состоит из трех спаренных оснований, фланкирующих центральное ядро из 15 консервативных (в основном инвариантных) нуклеотидов , как показано. Консервативные центральные основания, за немногими исключениями, необходимы для каталитической активности рибозима. Такие конструкции рибозима молоткообразной головки демонстрируют in vitro скорость оборота ( k cat ) около 1 молекулы/минуту и K m порядка 10 наномоляр.
Рибозим «молотоголовый» — это, пожалуй, наиболее охарактеризованный рибозим. Его небольшой размер, тщательно изученная химия расщепления, известная кристаллическая структура и его биологическая значимость делают рибозим «молотоголовый» особенно подходящим для биохимических и биофизических исследований фундаментальной природы катализа РНК.
Рибозимы Hammerhead могут играть важную роль в качестве терапевтических агентов; в качестве ферментов, которые адаптируют определенные последовательности РНК, в качестве биосенсоров , а также для применения в функциональной геномике и открытии генов. [9]
В 1986 году первые рибозимы молотоголового типа были обнаружены в РНК-патогенах растений, таких как вироиды и вирусные сателлиты. [5] [6] Год спустя рибозим молотоголового типа был также обнаружен в сателлитной ДНК геномов тритонов. [10] Затем новые примеры этого рибозима были обнаружены в геномах неродственных организмов, таких как шистосомы, [11] пещерные сверчки, [12] Arabidopsis thaliana [13] и нескольких млекопитающих, таких как грызуны и утконос. [14] В 2010 году было обнаружено, что рибозим молотоголового типа встречается в самых разных бактериальных и эукариотических геномах, [15] в том числе у людей. [16] Подобные отчеты подтвердили и расширили эти наблюдения, [17] [18] [19] открыв рибозим молотоголового белка как повсеместную каталитическую РНК во всех царствах жизни. [20]
Большинство эукариотических рибозимов молотоголовых связаны с короткими вкрапленными ретроэлементами (SINE), называемыми ретрозимами , которые экспрессируются в виде небольших кольцевых РНК. [21] Однако исключительную группу поразительно консервативных молотоголовых рибозимов можно обнаружить в геномах всех амниот . [16] Эти молотоголовые рибозимы (так называемые HH9 и HH10) встречаются в интронах нескольких специфических генов и указывают на сохраненную биологическую роль во время биосинтеза пре-мРНК. [22] В 2021 году было обнаружено, что новые геномы вируса гепатита D кольцевой РНК от разных животных кодируют молотоголовые рибозимы, подобные тем, которые присутствуют в растительных вироидах и вирусных сателлитах. [23] Массовый биоинформационный поиск агентов, подобных дельтавирусам, по всему миру выявил сотни примеров кольцевых РНК-геномов, содержащих мотивы в виде головки молотка, что указывает на то, что не только этот рибозим, но и небольшие кольцевые РНК с рибозимами являются вездесущими молекулами в биосфере. [24]
Молотоголовый рибозим осуществляет очень простую химическую реакцию, которая приводит к разрыву субстратной цепи РНК, в частности, в C17, нуклеотиде сайта расщепления. Хотя расщепление РНК часто называют гидролизом , используемый механизм на самом деле не включает добавление воды . Скорее, реакция расщепления представляет собой просто изомеризацию , которая состоит из перестройки связывающей фосфодиэфирной связи. Это та же самая реакция, химически, которая происходит при деградации РНК, опосредованной случайными основаниями , за исключением того, что она является высоко сайт-специфичной, и скорость ускоряется в 10 000 раз или более.

Реакция расщепления представляет собой реакцию изомеризации фосфодиэфира , которая инициируется отрывом 2'-гидроксильного протона рибозы сайта расщепления от 2'-кислорода, который затем становится атакующим нуклеофилом в «линейной» или S N 2(P) -подобной реакции, хотя неизвестно, удаляется ли этот протон до или во время химической стадии реакции расщепления молотковой головки. (Реакция расщепления технически не является бимолекулярной , но ведет себя так же, как настоящая реакция S N 2(P); она претерпевает инверсию конфигурации после образования ассоциативного переходного состояния, состоящего из пентакоординированного оксифосфрана.) Атакующий и уходящий групповые кислороды будут оба занимать два аксиальных положения в тригональной бипирамидальной структуре переходного состояния, как это требуется для механизма реакции S N 2.
5'-продукт, как результат этого механизма реакции расщепления, обладает 2',3'-циклическим фосфатным концом, а 3'-продукт обладает 5'-ОН-концом, как при неферментативном щелочном расщеплении РНК. Реакция, таким образом, обратима, поскольку расщепленный фосфат остается фосфодиэфиром и может, таким образом, выступать в качестве субстрата для лигирования, опосредованного молотковой РНК, без необходимости в АТФ или аналогичном экзогенном источнике энергии. [25] Реакция, катализируемая рибозимом молоткообразной головки, в отличие от формально идентичного неферментативного щелочного расщепления РНК, является высокоспецифичной для последовательности реакцией расщепления с типичной скоростью оборота приблизительно 1 молекулы субстрата на молекулу фермента в минуту при pH 7,5 в 10 мМ Mg2 + (так называемые «стандартные условия реакции» для минимальной последовательности РНК молоткообразной головки), в зависимости от последовательности конкретной измеренной конструкции рибозима молоткообразной головки. Это представляет собой приблизительно 10 000-кратное увеличение скорости по сравнению с неферментативным расщеплением РНК.
Первоначально считалось, что все рибозимы являются металлоферментами . Предполагалось, что двухвалентные ионы металлов, такие как Mg2 +, играют две роли: способствуют правильному сворачиванию РНК и формируют каталитическое ядро. [26] Поскольку сама РНК не содержит достаточного количества вариаций в функциональных группах, считалось, что ионы металлов играют роль в активном центре, как это было известно о белках. Предложенный механизм для иона Mg2+ был следующим: депротонирование группы 2'-ОН комплексом Magnesium.aqua.hydroxy, связанным кислородом pro-R в месте расщепления фосфата, с последующей нуклеофильной атакой полученного 2'-алкаоксида на расщепленный фосфат, образуя пентакоординированный промежуточный фосфат. Последний шаг - отщепление 5'-уходящей группы, что дает 2',3'-циклический фосфат с инвертированной конфигурацией. [27]
Было высказано предположение, что гексагидратированные ионы магния , которые существуют в равновесии с гидроксидом магния , могут играть роль общей кислоты и общего основания , аналогично тому, как это делают два гистидина в РНКазе А. Была также предложена дополнительная роль двухвалентных ионов металлов в форме электростатической стабилизации переходного состояния .
В 1998 году было обнаружено [28] , что рибозим молоткообразной формы, а также рибозим VS и рибозим шпильковой формы не требуют присутствия ионов металлов для катализа, при условии, что присутствует достаточно высокая концентрация одновалентного катиона , чтобы позволить РНК сворачиваться. Это открытие предполагает, что сама РНК, а не служит инертным, пассивным каркасом для связывания химически активных двухвалентных ионов металлов, вместо этого сама тесно вовлечена в химию катализа. Последние структурные результаты, описанные ниже, действительно подтверждают, что два инвариантных нуклеотида, G12 и G8, расположены в соответствии с ролями общего основания и общей кислоты в реакции расщепления молоткообразной формы.
Строго говоря, рибозим «молотоголовый» не может быть металлоферментом.
Минимальная последовательность молотка, необходимая для реакции саморасщепления, включает приблизительно 13 консервативных или инвариантных «ядерных» нуклеотидов, большинство из которых не участвуют в формировании канонических пар оснований Уотсона-Крика . Центральная область окружена Стеблями I, II и III, которые в целом состоят из канонических пар оснований Уотсона-Крика , но в остальном не ограничены относительно последовательности. Скорость каталитического оборота минимальных рибозимов молотка составляет ~ 1/мин (обычно наблюдается диапазон от 0,1/мин до 10/мин в зависимости от неконсервативных последовательностей и длины трех спиральных стеблей) при стандартных условиях реакции с высоким содержанием Mg2 + (~10 мМ), pH 7,5 и 25 °C. Большая часть экспериментальной работы, проведенной с рибозимами молотка, использовала минимальную конструкцию.
Структурно рибозим молотоголовый состоит из трех спиралей пар оснований, разделенных короткими линкерами консервативных последовательностей. Эти спирали называются I, II и III. Рибозимы молотоголовый можно разделить на три типа в зависимости от того, в какой спирали находятся 5' и 3' концы. Если 5' и 3' концы последовательности вносят вклад в стебель I, то это рибозим молотоголовый типа I, в стебель II — это тип II, а в стебель III — это рибозим молотоголовый типа III. Из трех возможных топологических типов тип I можно найти в геномах прокариот, эукариот и РНК-патогенов растений, тогда как тип II был описан только у прокариот [18] [19] , а тип III в основном встречается у растений, фитопатогенов и прокариот. [20] [22]
Полноразмерный молотоголовый рибозим состоит из дополнительных элементов последовательности в стеблях I и II, которые позволяют формировать дополнительные третичные контакты. Третичные взаимодействия стабилизируют активную конформацию рибозима, что приводит к скоростям расщепления до 1000 раз большим, чем для соответствующих минимальных молотоголовых последовательностей. [29] [30]
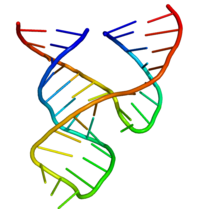
Минимальный рибозим молотоголовый был тщательно изучен биохимиками и энзимологами, а также рентгеновскими кристаллографами, ЯМР-спектроскопистами и другими специалистами по биофизическим методам. Первая подробная трехмерная структурная информация для рибозима молотоголовый появилась в 1994 году в виде рентгеновской кристаллической структуры рибозима молотоголовый, связанного с аналогом субстрата ДНК, опубликованной в Nature Плей, Флаэрти и Маккеем. [31] Впоследствии структура минимального рибозима молотоголовый полностью РНК была опубликована Скоттом, Финчем и Клугом в Cell в начале 1995 года . [32]
Минимальный рибозим «головка молотка» состоит из трех спиралей пар оснований, разделенных короткими линкерами консервативной последовательности, как показано в кристаллической структуре . [32] Эти спирали называются I, II и III. Консервативный уридиновый поворот связывает спираль I со спиралью II и обычно содержит последовательность CUGA. Спирали II и III связаны последовательностью GAAA. Реакция расщепления происходит между спиралью III и I и обычно представляет собой реакцию C.
Структура полноразмерного рибозима показывает, что между петлей стебля II и стебля I существуют обширные взаимодействия. [33]
Похожие структуры наблюдаются и в других рибозимах, например, в рибозимах- топориках .
Несмотря на наблюдения за катализом рибозима молоткообразной формы в кристалле минимальной последовательности молоткообразной формы, в котором упаковка контактов кристаллической решетки по необходимости ограничивала глобальные положения дистальных концов всех трех фланговых спиральных стеблей, многие биохимические эксперименты, направленные на исследование взаимодействий в переходном состоянии и химии катализа, по-видимому, несовместимы с кристаллическими структурами.
Например, было обнаружено, что инвариантные остатки ядра G5, G8, G12 и C3 в минимальном рибозиме типа «головка молотка» настолько хрупкие, что изменение даже одной экзоциклической функциональной группы в любом из этих нуклеотидов приводит к резкому снижению или отмене каталитической активности, однако лишь немногие из них, по-видимому, образуют водородные связи с участием поверхностей Уотсона-Крика этих нуклеотидных оснований в любой из минимальных структур типа «головка молотка», за исключением взаимодействия G-5 в структуре продукта.
Особенно ярким и недавно обнаруженным примером были G8 и G12, которые были идентифицированы как возможные участники кислотно-основного катализа. После того, как было продемонстрировано, что РНК-молот не требует двухвалентных ионов металлов для катализа, постепенно стало очевидно, что сама РНК, а не пассивно связанные двухвалентные ионы металлов, должна играть прямую химическую роль в любой кислотно-основной химии в активном центре рибозима-молот. Однако было совершенно неясно, как G12 и G8 могли это сделать, учитывая исходные структуры минимального рибозима-молот.
Другие опасения включали NOE между U4 и U7 расщепленного молоткообразного рибозима, который также наблюдался во время ЯМР- характеристики, что предполагало, что эти нуклеотидные основания должны приближаться друг к другу ближе, чем на 6 Å, хотя близкое сближение U7 и U4, по-видимому, невозможно из кристаллической структуры. Наконец, как обсуждалось ранее, атакующий нуклеофил в исходных структурах, 2'-OH C17, не находился в положении, подходящем для линейной атаки на соседний расщепляемый фосфат.
Возможно, наиболее тревожными были эксперименты, которые предполагали, что A-9 и расщепленные фосфаты должны находиться в пределах около 4 Å друг от друга в переходном состоянии, на основе двойного фосфоротиоатного замещения и экспериментов по спасению мягких ионов металлов; расстояние между этими фосфатами в минимальной структуре кристалла молотка составляло около 18 Å, без четкого механизма для близкого сближения, если спирали Stem II и Stem I A-формы рассматривать как жесткие тела. Взятые вместе, эти результаты, по-видимому, предполагают, что должно было произойти довольно крупномасштабное конформационное изменение, чтобы достичь переходного состояния в минимальной структуре рибозима молотка.
По этим причинам два набора экспериментов (биохимический против кристаллографического) оказались не только противоречащими друг другу, но и полностью и безнадежно непримиримыми, что породило существенные разногласия в этой области. Никаких убедительных доказательств для отклонения любого из наборов экспериментальных результатов так и не было получено, хотя в пользу каждого из них было сделано много заявлений об обратном.

В 2006 году была получена кристаллическая структура с разрешением 2,2 Å полноразмерного рибозима молотковидной формы. Эта новая структура (показана справа), по-видимому, разрешает наиболее тревожные из предыдущих несоответствий. В частности, C17 теперь расположен для атаки в линию, а инвариантные остатки C3, G5, G8 и G12, по-видимому, все вовлечены в жизненно важные взаимодействия, имеющие отношение к катализу. Более того, A9 и расщепленные фосфаты, как наблюдалось, находятся на расстоянии 4,3 Å друг от друга, что согласуется с идеей о том, что при модификации эти фосфаты могут связывать один тиофильный ион металла. Структура также показывает, как два инвариантных остатка, G-12 и G-8, расположены в активном центре, что согласуется с их ранее предложенной ролью в кислотно-основном катализе. G12 находится в пределах расстояния водородной связи с 2'–O C17, нуклеофилом в реакции расщепления, а рибоза G8 образует водородные связи с уходящей группой 5'-O. (см. ниже), в то время как нуклеотидное основание G8 образует пару Уотсона-Крика с инвариантным C3. Такое расположение позволяет предположить, что G12 является общим основанием в реакции расщепления, и что G8 может функционировать как общая кислота, что согласуется с предыдущими биохимическими наблюдениями. Водородные связи G5 с кислородом фуранозы C17 помогают расположить его для атаки в линию. U4 и U7, как следствие образования пары оснований между G8 и C3, теперь расположены таким образом, что NOE между их основаниями легко объясняется.
Таким образом, кристаллическая структура полноразмерного рибозима «молотоголовый» однозначно решает все основные проблемы, которые казались несовместимыми с предыдущими кристаллическими структурами минимального рибозима «молотоголовый».

Третичные взаимодействия в полноразмерном рибозиме молоткообразной формы стабилизируют то, что, по-видимому, является активной конформацией. Нуклеофил, 2'-кислород нуклеотида сайта расщепления, C17, выровнен почти идеально для линейной атаки (реакция S N 2(P)). G12 расположен в пределах расстояния водородной связи этого нуклеофила и, следовательно, может оторвать протон от 2'-кислорода, если сам G12 депротонируется. 2'-ОН G8 образует водородную связь с кислородом 5'-уходящей группы и, следовательно, потенциально может поставлять протон, поскольку отрицательный заряд накапливается на 5'-кислороде рибозы A1.1.
Наиболее вероятным объяснением тогда является то, что G12 в депротонированной форме является общим основанием, а рибоза G8 является общей кислотой. Очевидная кинетическая pKa [ необходимо разъяснение ] рибозима молотоголового рибозима составляет 8,5, тогда как pKa гуанозина составляет около 9,5. Возможно, что pKa G12 изменяется с 9,5 до 8,5 в каталитическом ядре молотоголового рибозима; эта гипотеза в настоящее время является предметом интенсивного исследования.

Если инвариант G8 меняется на C8, катализ молоткообразной формы отменяется. Однако двойной мутант G8C + C3G, который сохраняет пару оснований G8-C3, обнаруженную в полноразмерной молоткообразной форме, восстанавливает большую часть каталитической активности. Также было замечено, что 2'-OH G8 имеет важное значение для катализа; замена G8 на deoxyG8 значительно снижает скорость катализа, что позволяет предположить, что 2'-OH действительно имеет решающее значение для каталитического механизма.
Близкое расположение фосфатов A9 и scissile требует наличия высокой концентрации положительного заряда. Вероятно, это является источником наблюдения, что двухвалентные ионы металла требуются при низкой ионной силе, но могут быть исключены при более высоких концентрациях одновалентных катионов.
Таким образом, реакция, вероятно, включает в себя отрыв 2'-протона от C17, за которым следует нуклеофильная атака на соседний фосфат. Поскольку связь между расщепленным фосфором и уходящей группой 5'-O начинает разрываться, протон поставляется из рибозы G8, которая затем, вероятно, репротонируется за счет молекулы воды, которая, как наблюдалось, образует с ней водородную связь в кристаллической структуре.
Модифицированные рибозимы молотоголового типа тестируются в качестве терапевтических агентов. [34] Синтетические РНК, содержащие последовательности, комплементарные мутантной мРНК SOD1, и последовательности, необходимые для формирования каталитической структуры молотоголового типа, изучаются в качестве возможной терапии бокового амиотрофического склероза . Также ведутся работы по выяснению того, можно ли их использовать для создания устойчивых к ВИЧ линий Т-клеток. Было показано, что модифицированные аденовирусы молотоголового типа эффективны при лечении рака как in vitro, так и in vivo. [35]
Терапевтическое использование транс -расщепляющих молоткообразных рибозимов было серьезно затруднено их низкой активностью in vivo . Истинный каталитический потенциал транс -расщепляющих молоткообразных рибозимов может быть восстановлен in vivo , и терапевтические производные, вероятно, дополнят другие терапевтические стратегии гибридизации нуклеиновых кислот. Уже существуют молоткообразные рибозимы, которые близки к клиническому применению. [9]