В энзимологии оксидаза L-аминокислот (LAAO) ( EC 1.4.3.2) — это фермент , катализирующий химическую реакцию :
Фермент был впервые описан в 1944 году А. Целлером и А. Маритцем. [1] LAAO не только весьма изменчивы с точки зрения молекулярной массы, они также сильно различаются по стабильности. [2] В том же ключе этот фермент выполняет множество биологических функций, включая индукцию апоптоза , индукцию отека , кровоизлияние и ингибирование или индукцию агрегации тромбоцитов . [3]
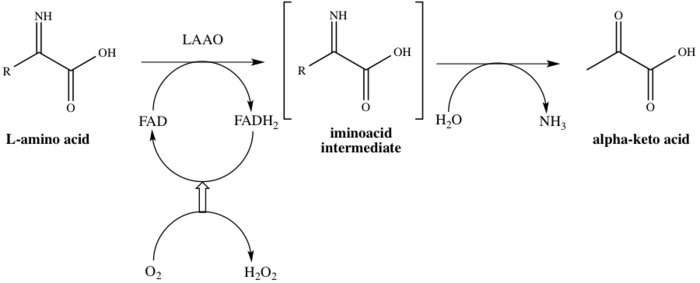
Как следует из названия семейства, LAAO являются флавоферментами , которые катализируют стереоспецифическое окислительное дезаминирование L- аминокислоты . [4] Три субстрата ферментативной реакции — это L- аминокислота , вода и кислород , тогда как три продукта — это соответствующая α- кетокислота (2-оксокислота), аммиак и перекись водорода . Один из примеров действия фермента происходит при превращении L-аланина в пировиноградную кислоту (2-оксопропионовую кислоту), как показано на рисунке 1.

Хотя LAAO присутствуют во множестве эукариотических и прокариотических организмов, [5] змеиный яд является особенно богатым источником фермента, и предполагается, что LAAO оказывают токсическое действие при отравлении. [3] [6] [7] LAAO, очищенные из ядов различных видов змей, оказались наилучшими кандидатами для изучения этого нового семейства ферментов. [8] Было установлено, что в большинстве случаев, касающихся семейств змей, таких как Viperidae , Crotalidae и Elapidae , змеиный яд-LAAO (sv-LAAO) составляет около 1-9% от общего количества белка. [9]
Большинство sv-LAAO, как сообщается, являются гомодимерами с несколькими субъединицами, имеющими молекулярную массу около 50–70 кДа [6] , а взаимодействие между субъединицами происходит посредством нековалентных взаимодействий . Sv-LAAO присутствуют в кислотной, основной и нейтральной формах белка. [6] Исследования, изучающие рентгеновские кристаллические структуры, подтвердили, что sv-LAAO часто встречаются в виде функциональных димеров, причем каждый димер имеет три домена. Три домена — это сайт связывания субстрата , сайт связывания FAD и спиральный домен. [8] Было определено, что сайт связывания субстрата фермента находится в основании длинной воронки, которая простирается на 25 Å от поверхности во внутреннюю часть белка. [8] Также было определено, что простетическая группа FAD становится глубоко укорененной в структуре фермента, что обеспечивает всеобъемлющие взаимодействия как с соседними атомами, так и с консервативными молекулами воды. [8] Кроме того, эта флавинсодержащая простетическая группа была классифицирована как обеспечивающая змеиному яду его типичную темно-желтую окраску, которая показана на рисунке 2. [10]
Одной из необычных характеристик, описанных для sv-LAAO, является способность белка инактивироваться при холоде и реактивироваться при нагревании. [11] Таким образом, большинство sv-LAAO считаются термолабильными ферментами. [9]
Этот фермент принадлежит к семейству оксидоредуктаз , в частности, тех, которые действуют на группу доноров CH-NH 2 с кислородом в качестве акцептора. Систематическое название этого класса ферментов — L-аминокислота: кислород оксидоредуктаза (дезаминирующая) . Этот фермент также называют офио-аминокислотной оксидазой . По состоянию на конец 2007 года для этого класса ферментов было решено 11 структур с кодами доступа PDB 1F8R, 1F8S, 1REO, 1TDK, 1TDN, 1TDO, 2IID, 2JAE, 2JB1, 2JB2 и 2JB3.
Были изучены специфические активности sv-LAAO с различными L-аминокислотами. Многие исследования показывают, что ряд sv-LAAO проявляют предпочтение к гидрофобным L-аминокислотам в качестве субстратов. [12] Например, результаты показали, что большинство sv-LAAO демонстрируют относительно высокую специфичность к гидрофобным аминокислотам, таким как L- Met , L- Leu и L- Ile, в дополнение к ароматическим аминокислотам, таким как L- Phe и L- Trp . [8] [13]
Этот фермент участвует в 8 метаболических путях : метаболизм аланина и аспартата , метаболизм метионина , деградация валина , лейцина и изолейцина , метаболизм тирозина , метаболизм фенилаланина , метаболизм триптофана , биосинтез фенилаланина , тирозина и триптофана и биосинтез алкалоидов . Он использует один кофактор , флавинадениндинуклеотид (ФАД). Фермент связывается с ФАД на первом этапе каталитического процесса, тем самым восстанавливая ФАД до ФАДН 2 . ФАД регенерируется из ФАДН 2 путем окисления в результате восстановления О 2 до Н 2 О 2 . Механизм протекает через окислительное дезаминирование L-аминокислоты, что дает промежуточное соединение иминокислоты . После гидролиза промежуточного соединения фермент успешно дает 2-оксокислоту, как показано на схеме 1. [8]
Были обнаружены различные биологические активности изолированных sv-LAAO, включая цитотоксическую , антибактериальную , противовирусную и противопаразитарную активность, а также эффекты агрегации тромбоцитов . [14] Эти активности можно определить по способности фермента провоцировать окислительный стресс путем образования кислородных радикалов и перекиси водорода . [15] Конкретный механизм действия sv-LAAO с точки зрения агрегации тромбоцитов был определен менее четко, поскольку известно, что некоторые sv-LAAO создают агрегаты, а некоторые являются антиагрегационными факторами. [16]
В недавних исследованиях было показано, что LAAO были выделены из кожных и/или жаберных слизистых выделений морского окуня, большого бычка и камбалы. [17] Было установлено, что присутствие этих ферментов является уникальным типом антибактериального белка во внешней защите, используемой некоторыми видами рыб.
Примечательно, что из-за его потенциала в соответствующих антимикробных , противоопухолевых клетках и/или потреблении аминокислот, интерес к исследованию sv-LAAO начал расти. [7] Многие авторы исследовали механизм антибактериального действия sv-LAAO. Хорошо известно, что sv-LAAO убивает и разрушает бактерии с помощью H 2 O 2 , которая образуется в результате реакции окисления, происходящей в окружающей среде. [7]
В одном исследовании случая сообщалось, что sv-LAAO (выделенный из яда C. durissus cascavella ) вызвал разрыв мембран бактерий , способствуя экстравазации или утечке плазматического содержимого из клеточной структуры. Они утверждали, что количество образующейся перекиси водорода было достаточным для ингибирования роста бактерий, и что способность фермента связываться с бактериальными мембранами не важна для его антибактериальной активности. [18]
Сердечно-сосудистые заболевания могут проявляться во многих различных формах, от кардиомиопатии до заболевания периферических артерий , и сердечные заболевания остаются ключевой угрозой для здоровья человека. Хотя существуют средства терапии как для профилактики, так и для лечения сердечно-сосудистых заболеваний , многие препараты недоступны для клинического использования из-за серьезных побочных эффектов в дополнение к высоким уровням токсичности. [9] Однако в последнее десятилетие sv-LAAO показали многообещающие результаты в воздействии на агрегацию тромбоцитов . Было высказано предположение, что перекись водорода играет важную роль в способности ферментов как вызывать, так и предотвращать эту агрегацию тромбоцитов . [9] С учетом этих знаний становится ясно, что sv-LAAO можно оценить как потенциальное терапевтическое средство для сердечно-сосудистых заболеваний из-за их биологической активности.
Вследствие многочисленных видов деятельности, в которых участвует фермент, можно сделать вывод, что, вероятно, существует некоторая ферментативная функция, касающаяся сложной сети действий ядовитых токсинов. [4] Однако роль sv-LAAO в патологии, вызванной ядом, не была достаточно изучена.
В силу своих антибактериальных свойств было высказано предположение, что sv-LAAO частично отвечают за поддержание и стабилизацию как яда, так и ядовитой железы у змей. [4]