UBE3A-ATS/Ube3a-ATS (человек/мышь), также известная как убиквитинлигаза E3A-ATS , — это название антисмысловой цепи ДНК, которая транскрибируется как часть более крупного транскрипта, называемого LNCAT (большой некодирующий антисмысловой транскрипт) в локусе Ube3a . Локус Ube3a импринтируется и в центральной нервной системе экспрессируется только с материнского аллеля. Считается, что подавление Ube3a на отцовском аллеле происходит черезчасть Ube3a-ATS LNCAT , [2], поскольку некодирующие антисмысловые транскрипты часто обнаруживаются в импринтированных локусах. [3] Делеция и/или мутация Ube3a на материнской хромосоме вызывает синдром Ангельмана (AS), и Ube3a-ATS может оказаться важным аспектом в поиске терапии этого заболевания. В то время как у пациентов с АС материнский аллель Ube3a неактивен, отцовский аллель нетронут, но эпигенетически подавлен. Если его не подавлять, отцовский аллель может быть источником активного белка Ube3a у пациентов с АС. Поэтому понимание механизмов того, как Ube3a-ATS может быть вовлечен в подавление отцовского Ube3a, может привести к новым методам лечения АС. Эта возможность была продемонстрирована в недавнем исследовании, где препарат топотекан , вводимый мышам, страдающим АС, активировал экспрессию отцовского гена Ube3a путем снижения транскрипции Ube3a-ATS . [4]
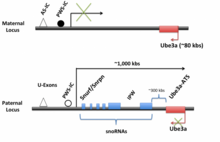
Человеческий UBE3A-ATS экспрессируется как часть LNCAT, в основном из отцовского аллеля в центральной нервной системе (ЦНС). [2] [7] Транскрипт имеет длину около 450 кб , начинается с U-экзонов и простирается до UBE3A на противоположной нити, возможно, за ее пределами. Промотор для Snurf / Snrpn и центр импринтинга находятся в области U-экзона. Промоторная область является обязательной, так как удаление этой области отменяет транскрипцию Ube3a-ATS . Рядом с промотором находится PWS-IC, а примерно в 35 кб выше PWS-IC находится AS-IC. Считается, что эти две области контролируют экспрессию всей нити LNCAT . Начиная с промотора, весь транскрипт может быть транскрибирован, а после транскрипции подвергается дальнейшей обработке и сплайсингу. Рассмотрено в Trends in Neurosci . [6]
Рядом с промоторной областью экзона U находится Snrpn/Snurf , который может быть альтернативно сплайсингован либо в Snrpn, либо в Snurf у людей (у мышей это остается одним бицистронным транскриптом). [8] Snrpn кодирует белок неизвестной функции, который локализуется в ядре клетки . Snurf кодирует небольшой ядерный рибонуклеопротеин . Хотя большинство этих белков участвуют в сплайсинге , роль этого конкретного белка пока неизвестна. [8] Ниже по течению от Snrpn/Snurf и внутри его интронов находятся последовательности для нескольких мРНК C/D-бокса . Большинство мРНК C/D-бокса функционируют в не- мРНК -метилировании . [8] [9] Однако недавно было обнаружено, что одна мРНК на Ube3a-ATS , SNORD 115, изменяет альтернативный сплайсинг пре-мРНК рецептора серотонина 2C. Кроме того, эта snoRNA обладает способностью изменять сплайсинг пяти различных мРНК. [10] Среди последовательностей snoRNA есть вложенный IPW (импринтированный Прадера-Вилли), некодирующая область, удаление которой, как полагают, вызывает синдром Прадера-Вилли . [11]
Ube3a-ATS/Ube3a мыши и человека являются ортологичными , и общая организация регионов схожа. Например, локус мыши также содержит Snurf/Snrpn , snoRNA и IPW. Основные различия заключаются в расположении и длине транскриптов Ube3a-ATS . Ube3a/Ube3a-ATS человека расположен на хромосоме 15 , тогда как Ube3a мыши расположен на хромосоме 7. LNCAT мыши , включая Ube3a-ATS , имеет длину около 1000 кб, что намного длиннее, чем LNCAT человека в 450 кб . [2] [6] [7] Благодаря схожей организации LNCAT мыши и человека и тому факту, что локус Ube3a мыши также импринтируется , мышь является превосходной модельной системой для изучения импринтинга и взаимодействий между Ube3a/Ube3a-ATs . Кроме того, нейроны мышей продолжают сохранять свой импринтинговый паттерн в культуре. [12]
Хотя весь транскрипт LNCAT , включая транскрипт Ube3a-ATS, может быть транскрибирован, он часто сплайсируется для включения и исключения различных экзонов. Различные варианты сплайсинга экспрессируются в различных типах тканей и ситуациях. В большинстве случаев считается, что по крайней мере некоторые типы Ube3a-ATS экспрессируются в клетках ЦНС, которые импринтируются, таких как клетки Пуркинье и нейроны гиппокампа . Однако существует пространственно-временная регуляция как нисходящей, так и восходящей части этого транскрипта. [13] и Journal of Neuroscience . [14]
У эмбрионов мышей экзоны Snurf/Snrpn были обнаружены в бластоцистах примерно через 7 дней после coitem и продолжали экспрессироваться на протяжении всего развития. Экзоны Snurf/Snrpn ограничены тканью ЦНС во время развития, и только позже во взрослом возрасте экспрессируются в других тканях. Экзоны Ube3a-ATS не были обнаружены до 10 дней после coitem, и их экспрессия также была ограничена ЦНС во время развития. В целом, Ube3a-ATS обнаруживается на начальных стадиях нейрогенеза, тогда как Snurf/Snrpn экспрессируется в недифференцированных клетках-предшественниках и на протяжении всего процесса дифференциации. [13] Согласно геномному браузеру UCSC, существует не менее 10 различных изоформ сплайсинга.
Согласно одному исследованию, вариант сплайсинга, который напрямую перекрывает Ube3a, обнаружен в цитоплазме. [15]
Считалось, что определенный кластер центров импринтинга контролирует дифференциальную экспрессию Ube3a-ATS на материнских и отцовских аллелях . В центрах импринтинга (IC) есть две области, которые связаны с AS и PWS — AS-IC и PWS-IC. Эти центры импринтинга являются контрольными областями, которые определяют, могут ли быть экспрессированы окружающие гены и области, и находятся как на материнских, так и на отцовских аллелях. В то время как дифференциальные паттерны метилирования на материнских и отцовских генах часто связаны с импринтингом, AS-IC остается неметилированным на обоих аллелях. Однако соседний PWS-IC метилирован на материнском аллеле, но остается неметилированным на отцовском аллеле. [16]
Предполагается, что PWS-IC контролирует экспрессию LNCAT и Ube3a-ATS . У мышей, у которых PWS-IC был удален, экспрессия Ube3a-ATS снижена. [5] В центральной нервной системе Ube3a-ATS преимущественно экспрессируется из отцовского аллеля, где PWS-IC не метилирован. [13] С другой стороны, на материнском аллеле, где PWS-IC метилирован, Ube3a-ATS не экспрессируется, что предполагает, что метилирование PWS-IC каким-то образом предотвращает экспрессию Ube3a-ATS . Это подтверждается несколькими исследованиями, в которых предотвращение метилирования PWS-IC путем отключения метилтрансфераз в эмбриональных стволовых клетках приводит к биаллельной экспрессии Ube3a-ATS и подавлению Ube3a на материнском аллеле. [10]
Однако метилирование — не единственный процесс, участвующий в предотвращении экспрессии материнского Ube3a-ATS . Ожидается, что домены импринтинга взаимодействуют с другими белками, которые способствуют подавлению LNCAT и Ube3a - ATS на материнском аллеле. Например, когда MECP2 выключается, как у пациентов с синдромом Ретта , Ube3a-ATS выражается биаллельно, снижая экспрессию Ube3a из материнского аллеля. [10]

Только одна РНК-полимераза (РНКП) может транскрибировать часть матрицы одновременно. Когда две РНКП транскрибируют в направлениях «лоб в лоб», может произойти столкновение. Это может привести к остановке обеих РНКП, откату одной РНКП или выпадению матрицы. В этом случае РНКП, транскрибирующая отцовский UBE3A-ATS, конкурирует с РНКП, транскрибирующей UBE3A, и выталкивает ее из матрицы, предотвращая транскрипцию UBE3A и допуская транскрипцию UBE3A-ATS. Стрелки показывают направление транскрипции. Обзор в Trends in Neurosci . [6] ]]
В настоящее время существует три модели, объясняющие, как Ube3a -ATS LNCAT подавляет отцовский Ube3a — модель столкновения, модель взаимодействия РНК-ДНК и модель двухцепочечной РНК- интерференции. [6] [15] Хотя эти модели не были продемонстрированы напрямую для Ube3a/Ube3a-ATS , они считаются правдоподобными на основе доказательств подавления других естественных антисмысловых транскриптов этими методами. Однако модель столкновения, благодаря последним подтверждающим исследованиям, представляется наиболее вероятной. [17] [18] [19]
Модель столкновения можно представить как дорогу, достаточно широкую для одного автомобиля. Умный автомобиль едет с одного направления, а плуг — с другого, в конечном итоге сталкиваясь. После столкновения плуг толкает умный автомобиль назад, в то время как он продолжает двигаться вперед. В модели столкновения для Ube3a/Ube3a-ATS РНК -полимеразы (РНКП) движутся навстречу друг другу по смысловой и антисмысловой матрицам во время транскрипции. Смысловая и антисмысловая матрицы перекрываются для Ube3a и Ube3a-ATS . Два транскрипционных пузыря столкнутся лоб в лоб, и РНКП, транскрибирующая Ube3a-ATS , будучи плугом, оттолкнет РНКП, транскрибирующую Ube3a ( умный автомобиль), назад и в конечном итоге с матрицы. Это предотвращает полную транскрипцию Ube3a. [6]
Поддержка этой модели исходит из двух недавних исследований. Первое исследование рассматривало транскрипцию генов на смысловых цепях , которые перекрывались генами, экспрессируемыми на антисмысловой цепи . Чем длиннее область перекрытия, тем менее эффективна была транскрипция смысловой цепи, указывая на то, что транскрипция на одной цепи мешает транскрипции на другой цепи. [19] Другое исследование напрямую отслеживало столкновения между РНК-полимеразами, транскрибирующими шаблон, с помощью атомно-силовой микроскопии. РНК-полимеразы останавливались на фрагментах ДНК и сталкивались с другими удлиняющимися РНК-полимеразами. Изображения показывали остановку двух РНК-полимераз сразу после столкновения, в дополнение к обратному отслеживанию одной из РНК-полимераз. [17]
Хотя эти исследования не проводились для Ube3a/Ube3a-ATS , использование атомно-силовой микроскопии для мониторинга транскрипции в этом локусе может дать представление о том, как Ube3a на самом деле подавляется через Ube3a-ATS . Дальнейшие исследования по-прежнему крайне необходимы для подтверждения этих моделей для Ube3a . [ требуется цитата ]
В то время как несколько исследований поддерживают идею о том, что Ube3a-ATS может быть вовлечен в отцовское подавление Ube3a , другие исследования противоречат этому. В частности, одно исследование выступает против ин-цис подавления Ube3 a с помощью Ube3a-ATS . В этом исследовании, когда материнский аллель Ube3a был удален, было замечено увеличение отцовской экспрессии Ube3a-ATS . Это говорит о том, что вместо того, чтобы отцовский Ube3a-ATS контролировал отцовский Ube3a , материнский Ube3a каким-то образом подавляет экспрессию отцовского Ube3a-ATs , возможно, в транс, а не в цис . Взаимодействие между материнскими и отцовскими гомологичными областями этих генов фактически наблюдалось в клетках человека и мыши во время интерфазы. [15]
Один из механизмов, который можно объяснить в транс -сайленсинге, включает взаимодействие между отцовской РНК Ube3a-ATS и материнской мРНК Ube3a . Возможно, что материнская мРНК Ube3a взаимодействует с отцовской РНК Ube3a-ATS и снижает стабильность обоих этих транскриптов. Когда производится только Ube3a-ATS без Ube3a , Ube3a-ATS становится более стабильной. [15]
Другое исследование предположило, что экспрессия Ube3a-ATS не происходит в импринтированных регионах. Гибридизации in situ не выявили Ube3a-ATS в клетках Пуркинье или нейронах гиппокампа. Однако были выражены другие экзоны выше по течению , соответствующие Snurf / Snrpn , [13] что указывает на то, что модель столкновения все еще может иметь место. Таким образом, все еще требуются дальнейшие исследования.
Несколько исследований пытались использовать возможность контроля экспрессии Ube3a через Ube3a-ATS . При АС отцовский PWS-IC не метилирован, что предположительно позволяет экспрессию Ube3a-ATS . Следовательно, если бы метилирование PWS-IC было возможно, транскрипция Ube3a-ATS могла бы быть запрещена, что позволило бы экспрессии Ube3a из отцовского аллеля компенсировать отсутствие экспрессии из материнского аллеля. Было проведено однолетнее исследование с несколькими пациентами с АС. Эти пациенты были помещены на диету, способствующую метилированию, которая состояла из бетаина , метафолина , креатина и добавок витамина B12 . Однако через год паттерны метилирования у этих пациентов не изменились. [20]
В другом исследовании была протестирована большая библиотека различных препаратов и выявлено несколько ингибиторов топоизомеразы I и II , которые увеличили экспрессию отцовского Ube3a в нейронах мышей и мышах. Ингибиторы топоизомеразы широко используются в качестве химиотерапевтических средств и вызывают апоптоз реплицирующихся клеток, вызывая двухцепочечные разрывы , которые останавливают репликативную вилку . Однако механизм их действия по активации отцовского Ube3a пока не известен, но может включать транскрипционное вмешательство с Ube3a-ATS , поскольку транскрипты Ube3a-ATS снижались после лечения препаратом. Группа специально решила изучить топотекан , который оказался наиболее эффективным в низком наномолярном диапазоне и уже одобрен Управлением по контролю за продуктами и лекарствами для лечения нескольких типов рака. [4]