Белок-регулятор транскрипции 1, содержащий домен WW (WWTR1 [5] ), также известный как транскрипционный коактиватор с мотивом связывания PDZ (TAZ), представляет собой белок , который у людей кодируется геном WWTR1 . WWTR1 действует как корегулятор транскрипции и не влияет на транскрипцию в одиночку. [5] В комплексе с партнерами по связыванию факторов транскрипции WWTR1 помогает стимулировать экспрессию генов в путях, связанных с развитием , ростом и выживанием клеток , а также ингибирует апоптоз . [6] Аберрантная функция WWTR1 была связана с его ролью в развитии рака . [7] [8] [9] WWTR1 часто называют TAZ из-за его первоначальной характеристики с названием TAZ. Однако WWTR1 (TAZ) не следует путать с белком тафаззином , который изначально имел официальный символ гена TAZ, а теперь называется TAFAZZIN.


WWTR1 содержит богатую пролином область, мотив связывания TEAD , домен WW , область спиральной спирали и домен трансактивации (TAD) , содержащий мотив связывания домена PDZ . WWTR1 (TAZ) не имеет домена связывания ДНК , поэтому он не может напрямую управлять транскрипцией. WWTR1 демонстрирует консервативную структурную гомологию с другим корегулятором транскрипции, yes-ассоциированным белком 1 (YAP) . [5] Как YAP, так и TAZ способны образовывать гомодимеры и гетеродимеры друг с другом посредством взаимодействий в домене спиральной спирали. [12] YAP и TAZ взаимодействуют с факторами транскрипции, способствуя формированию тканей . WWTR1 (TAZ) взаимодействует с различными транскрипционными партнерами, включая четыре члена семейства доменов TEA ( TEAD1 /2/ 3/ 4 ) через мотив связывания TEAD и несколько других факторов, содержащих мотив PPXY, который состоит из последовательности пролин - пролин -X (любая аминокислота ) - тирозин . Примерами таких партнеров являются Runx/PEBP2, AP2 , C/EBP, c-Jun , Krox-20 , Krox-24 , MEF2B , NF-E2 , Oct-4 и p73 , которые взаимодействуют с WWTR1 через домен WW. [6] Было показано, что домен трансактивации на C- конце (аминокислоты 165–395) важен для создания транскрипционных эффектов. [6]
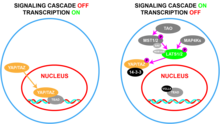
WWTR1 (TAZ) играет важную роль в эмбриогенезе и развитии , [13] [14] которые включают регуляцию размера органов, [15] [16] [17] обновление стволовых клеток , [18] регенерацию тканей , [19] [18] остеогенез , [20] и ангиогенез . [21] Эти функции осуществляются посредством коактивации факторов транскрипции, которые способствуют росту, миграции и дифференцировке клеток, [15] [16] [17] таких как четыре члена семейства факторов транскрипции TEAD, ген Paired box 3 (PAX3) и факторы транскрипции, связанные с Runt (RUNX1/) 2 ). [11] Пролиферативные функции WWTR1 (TAZ) и его паралога YAP ограничиваются сигнальным путем Hippo . [22] [23] [24] Этот подавляющий путь состоит из каскада киназных сигналов, ядро которого состоит из серин-треониновых киназ , STK3 / MST2 и STK4 / MST1 , которые, когда активны и образуют комплекс с регуляторным белком SAV1 , фосфорилируют и активируют киназы LATS1 / 2 , которые в комплексе с регуляторным белком MOB1 фосфорилируют и инактивируют YAP/TAZ. [14] [15] [25] Таким образом, активация Hippo останавливает рост клеток за счет снижения экспрессии пролиферативных генов, что приводит к снижению гибели клеток за счет ферроптоза [26] [27] и увеличению гибели клеток за счет апоптоза . [14] [15]
WWTR1 (TAZ) имеет схожую структурную последовательность и мотивы связывания с yes-ассоциированным белком 1 (YAP) . [11] YAP и TAZ часто считаются функционально избыточными в существующей литературе. [11] Оба играют роль в развитии размера органов, а также в миграции клеток , заживлении ран , ангиогенезе и метаболизме , особенно в липогенезе . [11] [28] Инактивация YAP и TAZ происходит посредством фосфорилирования киназами в пути Hippo, а именно LATS1 и LATS2. [11] Это вовлекает связывание регуляторного белка 14-3-3 , который предотвращает локализацию YAP/TAZ в ядре и помечает его для убиквитинирования , что позволяет распознавать его для последующей деградации протеасомами . [ 11]
TAZ способен образовывать как гетеродимеры , так и гетеротетрамеры с TEAD для инициации транскрипции (TAZ-TEAD и TAZ-TEAD-TAZ-TEAD), в то время как YAP способен образовывать только гетеродимеры YAP-TEAD . [11] Эти различия придают TAZ уникальные функции, такие как регуляция дифференцировки адипоцитов посредством взаимодействия с рецептором, активируемым пролифераторами пероксисом (PPARγ) , а также остеогенез посредством транскрипционной коактивации специфичных для костей факторов транскрипции, таких как RUNX2 (также известный как Cbfa1 ). [11] Кроме того, TAZ независимо взаимодействует с ядерным фактором активированных Т-клеток 5 (NFATC5) для подавления транскрипции в почечных клетках, которые подвергаются осмотическому стрессу . [11] YAP и TAZ связываются с комплексами транскрипционных факторов Mothers против decapentaplegic family (SMAD), способствуя передаче сигналов TGF-бета и управляя дифференцировкой и развитием, но при трансдукции этого каскада происходит повышение регуляции только TAZ. [11] TAZ способен образовывать комплексы только с SMAD2 , SMAD3 или SMAD4, способствуя ядерному челноку и транскрипции, но YAP также может взаимодействовать с SMAD1 и SMAD7 . [11] Исследования на мышах in vivo показали, что животные, у которых отсутствует функциональный TAZ, более жизнеспособны, чем животные, у которых отсутствует экспрессия YAP. [11] Напротив, подавление YAP способствовало более выраженному влиянию на расширение клеток, поглощение глюкозы и остановку клеточного цикла , чем TAZ. [11] При анализе клеточных линий немелкоклеточного рака легких (НМРЛ) WWTR1 поддерживал организацию и адгезию внеклеточного матрикса (ВКМ) и контролировал миграцию в большей степени, чем YAP, который более точно регулировал гены деления клеток и прогрессирования клеточного цикла. [11]


WWTR1 участвует во многих воспалительных заболеваниях, включая рак.
WWTR1 (TAZ) участвует в широком спектре видов рака, включая меланому, плоскоклеточный рак головы и шеи, рак молочной железы, немелкоклеточный рак легких и другие, из-за его высокой генной и гистологической экспрессии, а также корреляции с повышенным метастазированием и худшей выживаемостью в исследованиях на животных и данных пациентов. [9] Наряду со структурно схожим корегулятором YAP, во многих исследованиях описывается его роль в содействии онкогенезу, изменении неопластического метаболизма и формировании устойчивости к терапевтическому вмешательству. [8] [9] [33] [34] В частности, сверхэкспрессия TAZ обусловливает устойчивость к химиотерапии цисплатином , а также к иммунотерапевтическому лечению с использованием антитела PD-1 . [33]

Функции YAP и TAZ являются целевыми в нескольких терапевтических методах лечения рака.
Агонист сигнала Hippo , C19, увеличивает фосфорилирование MST1/2 и LATS1/2, что приводит к более глубокой инактивации YAP/TAZ. Модуляция жесткости и натяжения внеклеточного матрикса с использованием тиазовина , кукурбитацина I , дазатиниба , флувастатина и пазопаниба показала положительные результаты в линиях клеток рака молочной железы, предотвращая транслокацию YAP/WWTR1 в ядро. [35] Было также продемонстрировано, что эндогенные гормональные факторы, которые синтезируются для нормальных физиологических функций, такие как адреналин и глюкагон, оказывают аналогичное ингибирующее действие на функцию YAP/TAZ, способствуя активации пути Hippo. [35] Было показано, что класс ингибиторов холестерина , статины , ингибируют семейство Rho ГТФ-аз (Rho-GTPase) , которые являются ферментами , которые подают сигнал для восходящего ингибирования пути Hippo, и демонстрируют схожие эффекты в ослаблении роста клеток рака молочной железы и аденокарциномы легких человека . [35] Статины ингибируют 3-гидрокси-3-метил-глутарил-кофермент А-редуктазу (HMG-CoA-редуктазу) , которая является предшественником мевалоната в мевалонатном пути , который синтезирует липидные строительные блоки, которые образуют холестерины и липидные цепи, ответственные за прикрепление Rho-GTPases к клеточной мембране. [9] Rho-GTPase, гомолог A семейства Ras (RhoA) , активируется пренлилированием ( посттрансляционная модификация путем добавления гидрофобных групп ) и частично отвечает за модуляцию элементов цитоскелета , которые снижают активность пути Hippo. [9] При воздействии на Rho-киназы с помощью тиазовивина или липидного синтеза через мевалонатный путь с помощью статинов, RhoA ингибируется, а повышенная активность Hippo-киназы может ограничить пролиферацию, вызванную YAP/TAZ. [9] [35] Тирозинкиназы передают сигнал в пролиферативных путях, некоторые из которых способствуют функции YAP/TAZ, такие как киназы семейства Src и включают тирозинкиназу Yes, которая связана с функцией YAP. Воздействие на тирозинкиназы с помощью ингибиторов, таких как дазатиниб и пазопаниб, показало определенный эффект при раке. [9]
Также изучалось ингибирование функции YAP/TAZ путем воздействия на их взаимодействие с транскрипционными партнерами в семействе TEAD. [35] [36] Это включает использование вертепорфина , который исследовался при лечении рака кожи, в частности меланомы, хотя он не вышел за рамки доклинических исследований. [35]