Повреждение мозга, вызванное алкоголем [1] [2], изменяет как структуру, так и функцию мозга в результате прямого нейротоксического воздействия алкогольной интоксикации или острого алкогольного абстинентного синдрома. Повышенное потребление алкоголя связано с повреждением областей мозга, включая лобную долю , [3] лимбическую систему и мозжечок , [4] с распространенной церебральной атрофией или уменьшением мозга, вызванным дегенерацией нейронов . Это повреждение можно увидеть на нейровизуализационных сканах. [5]
Повреждение лобной доли становится наиболее заметным по мере старения алкоголиков и может привести к нарушению нейропсихологических показателей в таких областях, как решение проблем, здравый смысл и целенаправленное поведение. [3] Нарушения эмоциональной обработки являются результатом повреждения лимбической системы. Это может привести к проблемам с распознаванием эмоциональных выражений лица и «интерпретацией невербальных эмоциональных сигналов». [3]
Запойное пьянство или сильное эпизодическое пьянство может привести к повреждению лимбической системы, которое происходит через относительно короткий промежуток времени. Это повреждение мозга увеличивает риск слабоумия, связанного с алкоголем , а также отклонений в настроении и когнитивных способностях. У запойных алкоголиков также повышен риск развития хронического алкоголизма. Алкоголизм — это хроническое рецидивирующее расстройство, которое может включать длительные периоды воздержания с последующим рецидивом сильного пьянства. Он также связан со многими другими проблемами со здоровьем, включая нарушения памяти , высокое кровяное давление , мышечную слабость, проблемы с сердцем, анемию , низкую иммунную функцию, заболевания печени , расстройства пищеварительной системы и проблемы с поджелудочной железой. Он также коррелирует с депрессией , безработицей и семейными проблемами с повышенным риском домашнего насилия.
Пол и история алкоголизма и пьянства у родителей влияют на восприимчивость к алкогольной зависимости, поскольку более высокие уровни обычно наблюдаются у мужчин и у тех, у кого есть семейная история. [6]
Почти половина американских алкоголиков демонстрируют «нейропсихологические нарушения, [которые] могут варьироваться от легких до тяжелых» [3], и приблизительно два миллиона нуждаются в пожизненном уходе после развития постоянных и изнуряющих состояний. Длительное воздержание от алкоголя может привести к улучшению этих нарушений. У тех, у кого легкие нарушения, некоторое улучшение наблюдается в течение года, но это может занять гораздо больше времени у тех, у кого повреждения более серьезны. [3]
Импульсивность и поиск ощущений, наблюдаемые в подростковом возрасте, могут привести к увеличению потребления алкоголя и более частым эпизодам запоя, что делает подростков особенно подверженными риску алкоголизма. Все еще развивающийся мозг подростков более уязвим к разрушительным нейротоксическим и нейродегенеративным эффектам алкоголя. [7] "Высокая импульсивность [также] была обнаружена в семьях с алкоголизмом, что предполагает генетическую связь. Таким образом, генетика импульсивности пересекается с генетическими рисками расстройства, связанного с употреблением алкоголя, и, возможно, алкогольной нейродегенерации". [7]
Существует также генетический риск провоспалительного цитокинового опосредованного алкогольного повреждения мозга. Есть доказательства того, что варианты этих генов участвуют не только в содействии повреждению мозга, но также в импульсивности и злоупотреблении алкоголем. Все три эти генетические черты в значительной степени способствуют расстройству, связанному с употреблением алкоголя. [7]

Алкоголики обычно делятся на две категории: несложные и сложные. [4] Несложные алкоголики не имеют состояний дефицита питания или заболеваний печени, но имеют уменьшение общего объема мозга из-за атрофии белого вещества мозга. Тяжесть атрофии, вызванной употреблением алкоголя, пропорциональна скорости и количеству потребляемого алкоголя в течение жизни человека. [8] У сложных алкоголиков может быть повреждение печени, которое влияет на структуру и функции мозга, а также дефицит питания, «который может вызвать серьезное повреждение мозга и дисфункцию». [4] [8]
Подростки гораздо более уязвимы к повреждениям мозга, связанным с алкоголем, в форме стойких изменений в нейроиммунной сигнализации от запоя. [9] Эндокринная система включает гипоталамо-гипофизарно-надпочечниковую ось, гипоталамо-гипофизарно-гонадную ось, гипоталамо-гипофизарно-щитовидную ось, гипоталамо-гипофизарно-гормон роста/инсулиноподобный фактор роста-1 и гипоталамо-заднюю гипофизарную ось, а также другие источники гормонов, такие как эндокринная часть поджелудочной железы и эндокринная жировая ткань. Злоупотребление алкоголем нарушает работу всех этих систем и вызывает гормональные нарушения, которые могут привести к различным расстройствам, таким как непереносимость стресса, репродуктивная дисфункция, проблемы со щитовидной железой, иммунные нарушения, а также психологические и поведенческие расстройства. [10]
Атрофия головного мозга, которая часто встречается у алкоголиков, вызвана нейротоксичностью, вызванной алкоголем. [7] [11] Доказательства нейродегенерации могут быть подтверждены повышенной плотностью микроглии и экспрессией провоспалительных цитокинов в мозге. Исследования на животных показывают, что сильное и регулярное пьянство вызывает нейродегенерацию в кортиколимбических регионах мозга, которые участвуют в обучении и пространственной памяти. Пораженные кортиколимбические регионы мозга включают обонятельную луковицу , грушевидную кору , околоносовую кору , энторинальную кору и зубчатую извилину гиппокампа . Было обнаружено, что сильное двухдневное пьянство вызвало обширную нейродегенерацию в энторинальной коре с последующим дефицитом обучения у крыс. [6]
Неясно, как частота и продолжительность этих сеансов запоя влияют на повреждение мозга у людей. Люди, которые выпивали не менее 100 порций (мужчины) или 80 порций (женщины) в месяц (в основном 21 раз в месяц или меньше) в течение трехлетнего периода, имели нарушенные навыки принятия решений по сравнению с непьющими людьми. [6] МРТ -сканирование мозга показало, что уровень N-ацетиласпартата (NAA), метаболитного биомаркера нейронной целостности, был ниже у пьющих людей. Кроме того, были обнаружены аномальный метаболизм мозга, потеря белого вещества мозга в лобной доле и более высокие уровни NAA в теменном сером веществе. Это показывает корреляцию между запоем, плохой исполнительной функцией и рабочей памятью. Снижение уровня NAA в лобной доле связано с нарушением исполнительной функции и скоростью обработки в тестах на нейропроизводительность. [6]
Объем мозолистого тела , большого пути белого вещества, соединяющего два полушария мозга, уменьшается при злоупотреблении алкоголем из-за потери миелинизации. Эта интеграция между двумя полушариями мозга и когнитивной функцией нарушается. Ограниченное количество миелина может быть восстановлено при воздержании от алкоголя, что приводит к временным неврологическим дефицитам. [8]
Злоупотребление алкоголем влияет на нейроны в лобной коре, которые обычно имеют большую сому , или тело клетки. Этот тип нейронов более восприимчив к болезни Альцгеймера и нормальному старению. Исследования все еще проводятся, чтобы определить, существует ли прямая связь между чрезмерным употреблением алкоголя и болезнью Альцгеймера. [8]
Более высокий порядок функционирования коры головного мозга организован мозжечком. У людей с церебральной атрофией клетки Пуркинье или выходные нейроны мозжечка в черве уменьшаются в количестве на 43%. [8] Это большое сокращение клеток Пуркинье вызывает снижение организации коры головного мозга высокого порядка. Мозжечок также отвечает за очистку грубого моторного выхода из первичной моторной коры . Когда эта очистка отсутствует, будут проявляться такие симптомы, как неустойчивость и атаксия [8] . Потенциальной причиной хронической алкогольной мозжечковой дисфункции является изменение рецептора ГАМК-А . Эта дисфункция вызывает увеличение нейротрансмиттера ГАМК в мозжечковых клетках Пуркинье, зернистых клетках и интернейронах , что приводит к нарушению нормальной клеточной сигнализации. [8]

У запойных пьющих и алкоголиков, проходящих многократную детоксикацию, наблюдается дисфункция префронтальной коры , поскольку известно, что алкоголь оказывает долгосрочное воздействие на функцию префронтальной коры, что приводит к нарушениям в задачах исполнительного контроля. Исследования на животных показывают, что повторные отмены алкоголя связаны со значительным ухудшением способности усваивать новую информацию. [12] Острое воздействие алкоголя на усиление ГАМКергической активности и подавление NMDA вызывает вызванную алкоголем нейротоксичность и разжигание или ухудшение симптомов отмены алкоголя с каждым последующим периодом отмены. Это может вызвать угнетение ЦНС, приводящее к острой толерантности к этим эффектам отмены. За этой толерантностью следует разрушительный эффект отскока во время отмены. Этот отскок вызывает гипервозбудимость нейротрансмиссионных систем. Если это состояние гипервозбудимости возникает несколько раз, может возникнуть разжигание и нейротоксичность, что приведет к усилению повреждения мозга, связанного с алкоголем. Повреждающая эксайтотоксичность также может возникнуть в результате повторной отмены. Подобно людям, прошедшим многократную детоксикацию, у запойных пьющих наблюдается более высокий уровень эмоциональных расстройств из-за этих разрушительных эффектов. [12]
Тиамин — это витамин, необходимый вашему организму для роста, развития и клеточной функции, а также для преобразования пищи в энергию. Тиамин естественным образом присутствует в некоторых продуктах питания, добавляется в некоторые продукты питания и доступен в качестве пищевой добавки. [13] Дефицит тиамина в питании может усугубить повреждение мозга, связанное с алкоголем. Существует генетический компонент дефицита тиамина , который вызывает нарушение всасывания в кишечнике . [14] Состояние дефицита витаминов в питании, вызванное дефицитом тиамина, которое чаще всего наблюдается у алкоголиков, приводит к энцефалопатии Вернике и алкогольному синдрому Корсакова (АКС), которые часто возникают одновременно, известному как синдром Вернике–Корсакова (СВК). Это расстройство можно предотвратить путем дополнения рациона тиамином и осведомленности медицинских работников о необходимости лечения пациентов «группы риска» с помощью тиамина. [14] Дефицит тиамина может наблюдаться у более чем 80% пациентов с алкоголизмом, однако только у ≈13% таких людей развивается синдром Винчестера-Кушинга, что повышает вероятность того, что у некоторых людей может существовать генетическая предрасположенность к синдрому Винчестера-Кушинга. [15] [16] Повреждения или аномалии мозга обычно локализуются в промежуточном мозге и приводят к антероградной и ретроградной амнезии или потере памяти. [16]
Нейровизуализация используется для изучения влияния алкоголя на мозг. Два основных метода визуализации — гемодинамический и электромагнитный. Эти методы позволили изучить функциональные, биохимические и анатомические изменения мозга, вызванные длительным злоупотреблением алкоголем. [3] Нейровизуализация дает ценную информацию для определения риска развития алкогольной зависимости у человека и эффективности потенциального лечения. [3] [17]

Гемодинамические методы регистрируют изменения объема крови, кровотока, оксигенации крови и энергетического обмена для получения изображений. [3] Позитронно-эмиссионная томография (ПЭТ) и однофотонная эмиссионная компьютерная томография (ОФЭКТ) являются распространенными методами, которые требуют инъекции радиоактивно меченой молекулы, такой как глюкоза, для обеспечения надлежащей визуализации. После инъекции пациент затем наблюдается во время выполнения умственных задач, таких как задача на запоминание. Исследования ПЭТ и ОФЭКТ подтвердили и расширили предыдущие выводы, утверждающие, что префронтальная кора особенно восприимчива к снижению метаболизма у пациентов, злоупотребляющих алкоголем. [3]
Магнитно-резонансная томография (МРТ) и функциональная магнитно-резонансная томография (фМРТ) — другие часто используемые tenichiques. Эти методы неинвазивны и не несут в себе радиоактивного риска. Метод фМРТ регистрирует метаболические изменения в определенной структуре или области мозга во время умственной задачи. Для обнаружения повреждения белого вещества стандартной МРТ недостаточно. Производная от МРТ техника, известная как диффузионно-тензорная томография (ДТТ), используется для определения ориентации и целостности определенных нервных путей, что позволяет обнаружить повреждение. [3] При визуализации людей с алкоголизмом результаты ДТТ показывают, что сильное употребление алкоголя нарушает микроструктуру нервных волокон. [3]
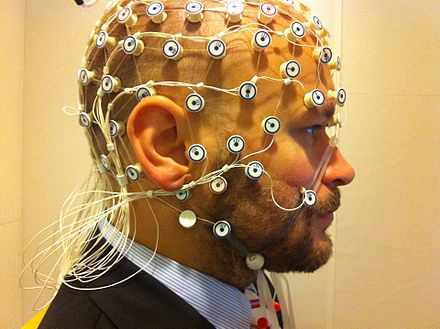
Хотя гемодинамические методы эффективны для наблюдения за пространственными и химическими изменениями, они не могут показать временной ход этих изменений. Методы электромагнитной визуализации способны фиксировать изменения в реальном времени в электрических токах мозга. [18] Электроэнцефалография (ЭЭГ) использует небольшие электроды, которые прикрепляются к коже головы. Записи усредняются с помощью метода, известного как потенциалы, связанные с событиями (ERP). Это делается для определения временной последовательности активности после воздействия стимула, такого как слово или изображение. [3]
Эти методы нейровизуализации показали, что алкоголь изменяет нервную систему на нескольких уровнях. [3] Это включает в себя нарушение функций ствола мозга низшего порядка и функций высшего порядка, таких как решение проблем. Эти методы также показали различия в электрической активности мозга и реакции при сравнении зависимых от алкоголя и здоровых людей. [3]
У пациентов с синдромом Корсакова МРТ показывает атрофию таламуса и мамиллярных тел. ПЭТ показывает снижение метаболизма и, следовательно, снижение активности в таламусе и других структурах промежуточного мозга. [14] У не осложненных алкоголиков, у тех, кто страдает хронической энцефалопатией Вернике (WE) и психозом Корсакова, наблюдалась значительная потеря нейронов в лобной коре, белом веществе, гиппокампе и базальных отделах переднего мозга . [14] У не осложненных алкоголиков наблюдалось уменьшение нейронов шва , мамиллярных тел и таламуса. [14]
Повреждение мозга, вызванное алкоголем, может иметь серьезные последствия для пострадавших и их близких. Возможности лечения очень ограничены по сравнению с другими расстройствами. Хотя и ограничены, большинство пациентов с когнитивными нарушениями, вызванными алкоголем, испытывали небольшое улучшение симптомов в течение первых двух-трех месяцев лечения. [8] Другие говорят, что наблюдают увеличение мозгового метаболизма уже через месяц после лечения. [3]
Обучение профилактике алкоголизма является наилучшим поддерживаемым методом избежания повреждения мозга, связанного с алкоголем. [8] Предоставляя информацию, которую исследования обнаружили в отношении факторов риска и механизмов повреждения, можно увеличить усилия по поиску эффективного лечения. Это также может снизить смертность, заставляя врачей уделять больше внимания предупреждающим знакам. [8]
Мозг является основной мишенью для действия алкоголя, и чрезмерное употребление алкоголя уже давно связывают с повреждением мозга. Исследования ясно показывают, что алкоголь нейротоксичен, оказывая прямое воздействие на нервные клетки. Хронические злоупотребляющие алкоголем подвергаются дополнительному риску повреждения мозга по связанным причинам, таким как плохое питание, заболевания печени и травмы головы.