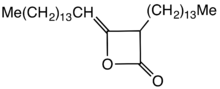
Алкилкетендимеры (АКД) представляют собой семейство органических соединений на основе 4-членной кольцевой системы оксетан-2-она , который также является центральным структурным элементом пропиолактона и дикетена . К оксетановому кольцу технически важных димеров алкилкетенов присоединена C 12 – C 16 алкильная группа в 3-положении и C 13 – C 17 алкилиденовая группа в 4-положении.
Основное применение димеров алкилированных кетенов — проклейка бумаги и картона , а также гидрофобизация целлюлозных волокон . Модифицированные таким образом продукты отличаются более высокой механической прочностью и меньшим проникновением воды, чернил или печатных красок . [1]
AKD содержат гидрофобные алкильные группы, отходящие от кольца бета-пропиолактона . Конкретный пример получен из димеризации кетена стеариновой кислоты . Этот кетен образуется в результате пиролиза стеароилхлорида. [2] AKD реагируют с гидроксильными группами целлюлозы посредством реакции этерификации . Этерификация конкурирует с гидролизом АКД. До разработки AKD гидрофобность придавалась добавлению в бумагу канифоли . [3]
С AKD связан алкенилянтарный ангидрид (ASA). Что касается AKD, ASA реагирует с гидроксигруппами целлюлозы с образованием сложного эфира, закрепляющего гидрофобную группу на поверхности. АСК получают еновой реакцией ненасыщенных углеводородов с малеиновым ангидридом . [4]
В 1901 году Эдгар Ведекинд опубликовал синтез димеров алкилкетенов реакцией хлоридов карбоновых кислот с третичными аминами : [5] [6]
RCH 2 COCl + R 3 N → RCH=C=O + R 3 NHCl Молекулярная масса, определенная ранними исследователями, указана ( CH 3 ) 2 CH=C=O ) n , где n > 1 для дегидрогалогенирования изобутирилхлорида триэтиламином . . [7] [8]

Первичные продукты реакции хлорангидридов кислот с атомами водорода в α-положении и третичных аминов были идентифицированы Германом Штаудингером [9] [10] и Норманом Томасом Мортимером Уилсмором [11] как высокореакционноспособные кетены (этеноны), образующие 2-оксетаноны с алкилиденовая группа при димеризации в режиме [2+2] фотоциклоприсоединения .
Понимание Штаудингера осложнялось зависимостью димеризации от заместителей. Простой кетен (H 2 C=C=O) димеризуется до дикетена (4-метилен-оксетан-2-она), а замещенные кетены, например диметилкетен (Me 2 C=C=O, образуются из изобутирилхлорида с триэтиламином ) димеризуются в результате присоединения «голова к хвосту» с 2,2,4,4-тетраметилциклобутандионом . [7] [12]
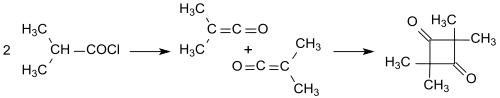
2,2,4,4,4-тетраметилциклобутандион легко изомеризуется в димер диметилкетена (4-изопропилиден-3,3-диметилоксетан-2-он). [13]
Синтез и характеристика димера гексадецилкетена, ключевого вещества для алкилированных димеров кетена, были впервые описаны в патенте [14] в 1945 году и в публикации [15] в 1947 году.
Промышленный синтез алкилированных кетендимеров (в то время еще называвшихся кетоэтенонами) был запатентован в 1945 году из хлорангидридов длинноцепных карбоновых кислот в инертных растворителях (таких как диэтиловый эфир или бензол ) с триэтиламином в качестве третичного амина в безводных условиях. После фильтрации нерастворимого гидрохлорида триэтиламина и выпаривания растворителя димеры длинноцепных алкильных цепей получаются с выходами более 90%. [14]
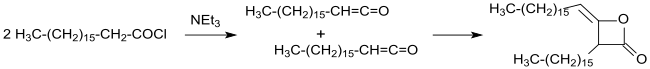
Использование других растворителей, таких как эфиры карбоновых кислот или кетоны , для более легкого разделения гидрохлоридов триалкиламинов или других аминов, таких как N,N,N',N'- тетраметилгексан-1,6-диамин [16], не обеспечивает какие-либо существенные преимущества.
Описаны также способы без использования растворителя, в которых полученный гидрохлорид амина либо отфильтровывают, либо экстрагируют разбавленными водными кислотами. [17]
Непрерывный процесс, в котором длинноцепочечный хлорангидрид карбоновой кислоты и третичный амин (например, диметилизопропиламин, диметилциклогексиламин или триэтиламин) подаются отдельно, без растворителей, в трубчатый реактор, месильную машину или предпочтительно двухшнековый экструдер или планетарный валковый экструдер и подвергаются реакции при температурах от 90 и 110 °C, обеспечивает содержание лактона более 90% при коротком времени реакции. Обработку осуществляют путем разделения фаз или кислотной экстракции. [18]
Проблемы с кислой (опосредованной сульфатом алюминия) массовой проклейкой бумаги с помощью канифольных смол, расщепляемых щелочью, возникшие с начала 19 века, привели помимо использования щелочных флокулянтов (таких как мел или карбонат кальция в качестве резерва щелочи) к поиску альтернативные материалы для калибровки в нейтральной или щелочной среде. В дополнение к значительно более реакционноспособным алкенилянтарным ангидридам (которые также быстро гидролизуются в присутствии воды) алкилированные димеры кетена стали предпочтительными размерами поверхности и массы в бумажной промышленности с 1960-х годов, начиная с 1950-х годов. [19]

Промышленно применяемые AKD получают из жирных кислот с длиной цепи от C14 ( миристиновая кислота ) до C22 ( бегеновая кислота ); Предпочтительно используют пальмитил(С16)дикетен и стеарил(С18)кетен и их смеси, а также смеси жирных кислот, полученные в результате гидролиза животных и растительных жиров. Из-за длины цепи исходных жирных кислот AKD представляют собой воскообразные твердые вещества с температурой плавления от 42 до примерно 70 °C. Смеси димеров алкилированных кетенов и воды представляют собой дисперсии при температуре ниже 40 °С или эмульсии при температуре выше 45 °С. Жидкие АКД широко не используются, они основаны на ненасыщенных жирных кислотах, таких как олеиновая кислота , или разветвленных жирных кислотах, таких как изостеариновая кислота.
Водные дисперсии алкилдикетенов обычно содержат 10-20 мас.% АКД, а также активные защитные коллоиды (особенно поликатионы , такие как катионный крахмал, сополимеры N -винилпирролидона и кватернизованного N - винилимидазола, ацилированные полиэтиленимины или катионные высокомолекулярные полиакриламиды со средней молярной молярностью). масса до 7 млн г/моль) и другие стабилизаторы (обычно анионные ПАВ, например лигнинсульфонаты или продукты конденсации натриевой соли нафталинсульфокислоты и формальдегида ). [20] Такие стабилизированные дисперсии АКД активны и стабильны при комнатной температуре до трех месяцев, а также допускают добавление различных наполнителей для бумаги или картона (например, каолина , мела, талька, диоксида титана , сульфата кальция , оксида алюминия и т. д. ) от 5 до 25%. Количества димеров алкилкетена, используемых для проклейки бумаги и бумажных изделий, предпочтительно находятся в диапазоне от 0,15 до 0,8% мас., иногда от 0,05 до 0,2% мас. [18] в расчете на сухую бумажную массу.
Для калибровки бумаги с помощью AKD был предложен трехэтапный процесс, который, несмотря на спорные дискуссии в 1990-х годах, кажется, лучше всего описывает происходящие процессы и объясняет достигнутые результаты. [21] Решающими критериями качества гидрофобности бумаги являются

Молекулярная структура (т.е. молярная масса и степень сшивки), молярная плотность заряда катионных групп, точная дозировка катионного полимера в качестве стабилизатора дисперсии и средства удержания, а также соблюдение других параметров процесса, таких как температура, pH и время пребывания имеет решающее значение.
После удаления избытка воды - также во избежание гидролиза АКД до бета-кетокислоты и последующего декарбоксилирования до кетона -

следует за растрескиванием стабилизированных частиц AKD на бумажной массе, плавлением твердого воска AKD (приблизительно 90 °C), распространением жидкого воска AKD путем поверхностной диффузии на целлюлозные волокна и образованием замкнутых гидрофобных слои. Толщина гидрофобных слоев зависит от концентрации АКД в дисперсии. [22]
Объявление 3. Гидрофобизация целлюлозных волокон димерами алкилированных кетенов наиболее эффективно протекает в нейтральных или предпочтительно слабощелочных средах (рН 7,5-9,0). Температура реакции обычно составляет 90-110°C, при этом примерно 40% используемого AKD реагирует с целлюлозой. [21] После реакции были измерены краевые углы >100°, что указывает на гидрофобный характер поверхностей модели, модифицированной AKD. Этерификация гидроксильных групп целлюлозных волокон также была продемонстрирована с помощью сравнительных реакций с 14 C-меченым AKD. [21]
Проклейка AKD подходит для постоянной гидрофобизации газетной, печатной и писчей бумаги и картона, используемых в качестве контейнера для жидкостей (включая пищевые продукты, такие как молоко), а также для улучшения стабильности формы и текучести.