Бактериопланктон относится к бактериальному компоненту планктона , который дрейфует в толще воды. Название происходит от древнегреческого слова πλανκτος ( планктос ), что означает «странник» или «бродяга», и бактерия — латинского термина, придуманного в 19 веке Кристианом Готфридом Эренбергом . Они встречаются как в морской , так и в пресной воде .
Бактериопланктон занимает ряд экологических ниш в морских и водных экосистемах. Они являются как первичными производителями, так и первичными потребителями в этих экосистемах и управляют глобальным биогеохимическим круговоротом элементов, необходимых для жизни (например, углерода и азота). Многие виды бактериопланктона автотрофны и получают энергию либо в результате фотосинтеза , либо в результате хемосинтеза . Фотосинтетический бактериопланктон часто относят к пикофитопланктону и включают основные группы цианобактерий , такие как прохлорококк и синехококк . Другой гетеротрофный бактериопланктон является сапротрофным и получает энергию, потребляя органический материал, производимый другими организмами. Этот материал может быть растворен в среде и взят непосредственно оттуда, или бактерии могут жить и расти в сочетании с твердым материалом, таким как морской снег . Бактериопланктон играет решающую роль в глобальной фиксации азота , нитрификации , денитрификации , реминерализации и метаногенезе .
Численность бактериопланктона зависит от переменных окружающей среды, таких как температура, наличие питательных веществ и хищничество. Как и другой мелкий планктон, бактериопланктон является объектом охоты зоопланктона ( обычно простейших ), и их численность также контролируется путем заражения бактериофагами .

Фотосинтетический бактериопланктон отвечает за значительную долю общей первичной продукции водных пищевых сетей, поставляя органические соединения на более высокие трофические уровни. Эти бактерии подвергаются оксигенному и аноксигенному фотосинтезу . Различия между этими процессами можно увидеть в образующихся побочных продуктах, первичном доноре электронов и светособирающих пигментах, используемых для захвата энергии.

Цианобактерии — большая группа фотосинтезирующего бактериопланктона, часто растущего в виде клеток или нитевидных колоний. [1] Эти организмы являются доминирующей группой бактериопланктона, использующей кислородный фотосинтез в водных экосистемах. Цианобактерии, наряду с фотосинтезирующими эукариотами, отвечают за примерно половину общего мирового первичного производства [2] , что делает их ключевыми игроками в пищевой сети. Они используют фотосинтез для получения энергии в виде органических соединений и производят кислород в качестве побочного продукта. [3] Основные светособирающие пигменты включают хлорофиллы , фикоэритерин , фикоцианин и каротиноиды . [4] Большинство цианобактерий, обитающих в морской среде, представлены родами Synechococcus и Prochromococcus . Synechococcus является космополитом: сообщалось о его распространении в умеренных и тропических водах. [5] Прохлорококк имеет очень маленькие размеры и встречается преимущественно в эвфотической зоне тропических вод. [6] [7] Факторы, в том числе свет, питательные вещества и температура, могут привести к размножению цианобактерий и образованию вредоносного цветения. [8] Цветение цианобактерий может вызывать гипоксию и производить высокие уровни токсинов, влияя на другие водные организмы, а также вызывая заболевания у людей.
Некоторые цианобактерии способны к фиксации азота . Род Anabaena использует специализированные клетки, называемые гетероцистами, для физического разделения фиксации азота и фотосинтеза. [9] Триходезмий является примером цианобактерий, способных фиксировать азот альтернативным путем фотосинтеза. [10]
Другой фотосинтезирующий бактериопланктон, включая пурпурные и зеленые бактерии, подвергается аноксигенному фотосинтезу в анаэробных условиях. Пигменты, синтезируемые этими организмами, чувствительны к кислороду. У пурпурных бактерий основными пигментами являются бактериохлорофиллы А и В и каротиноиды. Зеленые бактерии имеют разные светособирающие пигменты, состоящие из бактериохлорофиллов c, d и e. [1] Эти организмы не производят кислород посредством фотосинтеза и не используют воду в качестве восстановителя. Многие из этих организмов используют серу, водород или другие соединения в качестве источника энергии для фотосинтеза. Большая часть этого бактериопланктона обитает в бескислородных водах , включая застойные и гиперсоленые среды. [11]
Гетеротрофный бактериопланктон зависит от доступной концентрации растворенного органического вещества в толще воды. Обычно эти организмы являются сапрофитными и поглощают питательные вещества из окружающей среды. Эти гетеротрофы также играют ключевую роль в микробном цикле и реминерализации органических соединений, таких как углерод и азот. Pelagibacterales (синоним SAR11), также известные как представители клады Alphaproteobacteria , являются наиболее многочисленным бактериопланктоном в океанах. Представители этой группы обитают в водах с низким содержанием питательных веществ и становятся объектом охоты простейших. [12] [13]
Roseobacter — это разнообразная и широко распространенная клада, которая составляет значительную часть морского бактериопланктона, составляя примерно 20% прибрежных вод и 15% смешанного поверхностного слоя океанов. Хотя многие из них являются гетеротрофами, некоторые способны осуществлять уникальную форму фотосинтеза, называемую аэробной аноксигенной фототрофией , которая требует, а не производит кислород. [14] [15]
Атмосферный углерод улавливается в океане тремя основными насосами, известными уже 30 лет: насосом растворимости , карбонатным насосом и биологическим углеродным насосом (BCP). [16] Биологический углеродный насос представляет собой насос с вертикальной трансмиссией, приводимый в действие главным образом за счет погружения частиц, богатых органическими веществами. Бактериальный фитопланктон у поверхности включает в свою биомассу атмосферный CO 2 и другие питательные вещества в ходе фотосинтеза. В момент своей смерти этот фитопланктон вместе с включенным в него углеродом опускается на дно океана, где углерод сохраняется в течение тысяч лет. [17] Другой биологически опосредованный способ связывания углерода в океане происходит посредством микробного насоса. Микробный насос отвечает за производство старого неподатливого растворенного органического углерода (DOC), возраст которого превышает 100 лет. [16] Планктон в океане не способен расщеплять этот непокорный DOC, и поэтому он остается в океанах в течение 1000 лет, не подвергаясь дыханию. Два насоса работают одновременно, и считается, что баланс между ними варьируется в зависимости от наличия питательных веществ. [18] В целом океаны действуют как поглотитель атмосферного CO 2 , но также выделяют некоторое количество углерода обратно в атмосферу. [19] Это происходит, когда бактериопланктон и другие организмы в океане потребляют органическое вещество и выдыхают CO 2 , а также в результате равновесия растворимости между океаном и атмосферой.
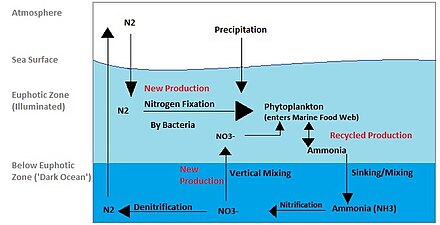
Круговорот азота в океанах опосредован микроорганизмами, многие из которых являются бактериями, выполняющими множественные преобразования, такие как: фиксация азота , денитрификация , ассимиляция и анаэробное окисление аммиака ( анаммокс ). Бактериопланктон использует множество различных стратегий метаболизма азота. Начиная с молекулярного азота в атмосфере (N 2 ), который фиксируется диазотрофами , такими как триходезмий, в пригодные для использования формы, такие как аммиак ( NH+
4). [20] Этот аммиак затем может усваиваться в органические вещества, такие как аминокислоты и нуклеиновые кислоты, как фотоауттрофным, так и гетеротрофным планктоном, а также нитрифицироваться до NO .−
3для производства энергии с помощью нитрифицирующих бактерий. Наконец, использование NO−
3или НЕТ−
2как терминальные акцепторы электронов восстанавливают азот обратно в N 2 , который затем выбрасывается обратно в атмосферу, замыкая цикл. [21] Другим важным процессом, участвующим в регенерации атмосферного N 2, является анаммокс. [21] [22] Анаммокс, процесс, в котором аммиак сочетается с нитритом для производства двухатомного азота и воды, может составлять 30–50% производства N 2 в океане. [22]
Анализ метагеномов 83 видов цианобактерий предположил возможное диссимиляционное восстановление активности нитрата до аммония (ДНРА) у некоторых цианобактерий. [23] А именно, исследование выявило наличие гена NirBD , который является маркером функции ДНКRA, в семействах Leptolingbyaceae и Nostocaceae . Более того, исследование показало, что цианобактерии, у которых был NirBD, в значительной степени также являются негетероцистными азотфиксаторами , что предполагает возможные альтернативные стратегии приобретения азота в различных условиях окружающей среды. Тем не менее, известно, что ген NirBD также играет роль в ассимиляции азота [24] , и необходимы дальнейшие исследования для выяснения функции NirBD у цианобактерий.
Растворенное органическое вещество (РОВ) доступно в океане во многих формах и отвечает за поддержку роста бактерий и микроорганизмов в океане. Двумя основными источниками растворенного органического вещества являются; разложение организмов более высокого трофического уровня, таких как растения и рыбы, и, во-вторых, РОВ в стоках, которые проходят через почву с высоким содержанием органического материала. Важно отметить, что возраст и качество РОВ важны для его использования микробами. [25] Большая часть РОВ в океанах тугоплавка или полулабильна и не подлежит биоразложению. [26] Как упоминалось выше, микробный насос отвечает за производство тугоплавкого РОВ, который не поддается биоразложению и остается растворенным в океанах на протяжении тысячелетий. [16] Оборот лабильного органического материала РОВ довольно высок из-за его дефицита, это важно для поддержания нескольких трофических уровней в микробном сообществе. [27] Поглощение и дыхание РОВ гетеротрофами замыкает цикл с образованием CO 2 .
Бактериопланктон, такой как представители Roseobacter , SAR11 и Gammaproteobacteria , как известно, вносит значительный вклад в цикл серы, [15] [28] главным образом за счет метаболизма диметилсульфониопропионата (DMSP). ДМСП может катаболизироваться либо путем расщепления до диметилсульфида (ДМС), либо путем деметилирования бактериопланктоном, [29] [30], при этом оба метода оказывают разное влияние на цикл серы . Образование DMS способствует потоку серы в атмосферу и, согласно гипотезе CLAW , играет роль в регулировании глобального климата. [31] Увеличение производства сульфатных аэрозолей в результате окисления ДМС способно способствовать похолоданию в глобальном масштабе за счет содействия образованию облаков. [31] [32] Напротив, путь деметилирования от ДМСП до метантиола приводит к интеграции углерода и серы в сам организм, а не к высвобождению элементов обратно в окружающую среду. [33] Считается, что деградация DMSP бактериопланктоном преобладает в морских поверхностных водах, хотя пространственное распределение двух вышеупомянутых путей деградации сильно варьируется. [34]
Подобно DNRA, то же исследование показало наличие dsyB -подобного гена в геномах некоторых цианобактерий, что указывает на способность продуцировать DMSP. [23] Однако до сих пор нет эмпирического подтверждения синтеза ДМСП у цианобактерий.
Диатомовые водоросли представляют собой основную группу фитопланктона, большинство из которых нуждаются в кремнии в качестве биогенного кремнезема для формирования клеточной стенки (известной как панцирь ). В случае нападения хищников или смерти из диатомовых водорослей выделяются частицы кремнезема, но их необходимо растворить для переработки и повторного поглощения диатомовыми водорослями, в противном случае кремнезем будет вывезен и отложен в отложениях. Следовательно, продуктивность диатомей будет ограничена кремнием, если скорость растворения будет низкой. Однако известно, что бактериопланктон (т.е. представители Cytophaga - Flavobacterium - Bacteroides , Alphaproteobacteria и Gammaproteobacteria ) в значительной степени способствуют растворению твердых частиц кремнезема, тем самым поддерживая значительное производство биогенного кремнезема в фотической зоне океана. Предполагается также, что этот процесс помогает регулировать продуктивность диатомей и соответствующие ей биогеохимические эффекты. [35] [36]

Колебания численности бактериопланктона обычно являются результатом температуры, выпаса зоопланктона и наличия субстрата. [37] Численность и продуктивность бактерий постоянно связаны с численностью и продуктивностью водорослей, а также с содержанием органического углерода. Кроме того, фосфор напрямую влияет на численность как водорослей, так и бактерий, а водоросли и бактерии, в свою очередь, напрямую влияют на численность друг друга [37]. В чрезвычайно олиготрофных средах рост как бактерий, так и водорослей ограничивается фосфором, но поскольку бактерии являются лучшими конкурентами, они получают большую часть неорганического субстрата и увеличиваются в численности быстрее, чем водоросли.
В морской пелагической среде гетеротрофные наножгутики являются наиболее вероятными потребителями продукции бактериальных клеток. [38] Культивированные жгутиконосцы в лабораторных экспериментах показывают, что они адаптированы к поеданию частиц размером с бактерию и встречаются в концентрациях, позволяющих контролировать бактериальную биомассу. [39] В эвтрофном устье реки, особенно летом, были обнаружены резкие колебания численности бактерий и жгутиконосцев . [38] [40] Амплитуда этих колебаний увеличивается в ответ на искусственную эвтрофикацию неорганическими питательными веществами и уменьшается в ответ на хищничество. Потери бактериопланктона при выпасе косвенно связаны с балансом углерода и напрямую связаны с прокариотными ингибиторами. [41] Избыток субстрата может привести к увеличению биомассы жгутиковых, увеличению потребления бактериопланктона и, следовательно, к снижению бактериальной биомассы в целом. Хищничество инфузорий аналогично хищничеству жгутиконосцев на бактериях.
При сезонном использовании прокариотических ингибиторов наблюдается положительная связь между численностью бактерий и скоростью выедания гетеротрофного нанопланктона, и только 40-45% продукции бактериопланктона потребляется фаготрофными простейшими. [42] Кроме того, эксперименты по ингибированию эукариот показывают, что выпас простейших оказывает положительное влияние на производство бактериопланктона, что позволяет предположить, что регенерация азота простейшими может быть очень важна для роста бактерий. Эукариотические ингибиторы не оказались полезными для определения скорости поедания простейшими бактериопланктона, однако они могут помочь понять механизмы контроля в микробной пищевой сети. [42]

Бактериопланктон, такой как цианобактерии, способен вызывать токсичное цветение в эвтрофных озерах, что может привести к гибели многих организмов, таких как рыбы, птицы, крупный рогатый скот, домашние животные и люди. [43] Несколькими примерами этих вредоносных цветений являются цветение Microcystis в 2000 году в устье реки Суон, Австралия, [44] и Oostvaarderplassen в Нидерландах в 2003 году. [45] Пагубные последствия этого цветения могут варьироваться от сердца. пороки развития у рыб [46] и ограничивают размножение копепод. [47]
Высокие температуры, вызванные сезонностью, усиливают стратификацию и предотвращают вертикальное турбулентное перемешивание, что усиливает конкуренцию за свет, благоприятствующую плавучим цианобактериям. [48] [49] Более высокие температуры также уменьшают вязкость воды, что обеспечивает более быстрое движение, что также благоприятствует плавучим видам цианобактерий. [43] Эти виды также очень конкурентоспособны благодаря способности создавать поверхностный покров, предотвращающий попадание света в более глубокие виды планктона. [48] [50] [49]
Климатические исследования также показывают, что с увеличением жарких волн вероятность пагубного цветения цианобактерий станет более серьезной угрозой для эвтрофных пресноводных систем. [51] [52] [53] Другими последствиями повышения средней температуры воздуха из-за изменения климата является то, что может произойти расширение сезона цветения цианобактерий, простирающегося с начала весны до поздней осени. [54]
Оценки численности и плотности бактериопланктона можно получить с помощью различных методов, включая прямой подсчет, проточную цитометрию и выводы, сделанные на основе метаболических измерений.
Кроме того, как обсуждалось в разделе о биогеохимическом цикле, планктон отвечает за переработку и перемещение необходимых питательных веществ (т.е. азота/углерода/РОВ), которые являются важными строительными блоками для многих организмов, сосуществующих с бактериопланктоном в этих экосистемах. Эти переработанные питательные вещества могут быть повторно использованы первичными производителями, тем самым повышая эффективность биологической пищевой сети и сводя к минимуму энергетические отходы.