В химии , кристаллографии и материаловедении координационное число , также называемое лиганцией , центрального атома в молекуле или кристалле — это количество атомов, молекул или ионов, связанных с ним. Ион/молекула/атом, окружающий центральный ион/молекулу/атом, называется лигандом . Для молекул это число определяется несколько иначе, чем для кристаллов.
Для молекул и многоатомных ионов координационное число атома определяется простым подсчетом других атомов, с которыми он связан (одинарными или кратными связями). [1] Например, [Cr(NH 3 ) 2 Cl 2 Br 2 ] − имеет Cr 3+ в качестве центрального катиона, который имеет координационное число 6 и описывается как гексакоординат . Общие координационные числа — 4 , 6 и 8.

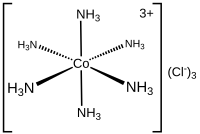

В химии координационное число , первоначально определенное в 1893 году Альфредом Вернером , представляет собой общее число соседей центрального атома в молекуле или ионе. [1] [3] Эта концепция чаще всего применяется к координационным комплексам .
Наиболее распространенное координационное число для комплексов переходных металлов d- блока - 6. Координационное число не различает геометрию таких комплексов, то есть октаэдрическую или тригонально-призматическую.
Для комплексов переходных металлов координационные числа варьируются от 2 (например, Au I в Ph 3 PAuCl) до 9 (например, Re VII в [ReH 9 ] 2- ). Металлы в f -блоке ( лантаноиды и актиноиды ) могут иметь более высокое координационное число из-за их большего ионного радиуса и наличия большего количества орбиталей для связывания. Для элементов f -блока обычно наблюдаются координационные числа от 8 до 12 . Например, с бидентатными нитрат- ионами в качестве лигандов Ce IV и Th IV образуют 12-координационные ионы [Ce(NO 3 ) 6 ] 2- ( цериевая селитра аммония ) и [Th(NO 3 ) 6 ] 2- . Когда окружающие лиганды намного меньше центрального атома, возможны даже более высокие координационные числа. Одно исследование вычислительной химии предсказало особенно стабильный PbHe.2+
15ион, состоящий из центрального иона свинца , координированного не менее чем с 15 атомами гелия. [4] Среди фаз Франка-Каспера упаковка металлических атомов может давать координационные числа до 16. [5] Напротив, стерическое экранирование может привести к необычно низким координационным числам. Чрезвычайно редкий случай, когда металл принимает координационное число 1, встречается в комплексе арилталлия(I) на основе терфенила 2,6-Tipp 2 C 6 H 3 Tl, где Tipp представляет собой 2,4,6-триизопропилфенильную группу. [6]
Координационные числа становятся неоднозначными при работе с полигапто-лигандами. Для π-электронных лигандов, таких как циклопентадиенид- ион [C 5 H 5 ] - , алкены и циклооктатетраенид- ион [C 8 H 8 ] 2- , число соседних атомов в π-электронной системе, которые связываются с центральным атомом, равно называется тактильностью . [7] В ферроцене гаптичность η каждого циклопентадиенидного аниона равна пяти, Fe( η 5 -C 5 H 5 ) 2 . Существуют различные способы определения вклада каждого циклопентадиенидного лиганда в координационное число центрального атома железа. Вклад можно определить как единицу, поскольку имеется один лиганд, или как пять, поскольку имеется пять соседних атомов, или как три, поскольку задействованы три электронные пары. Обычно производится подсчет электронных пар. [8]
Координационные числа атомов внутри кристаллической решетки четко определены : ближайшие соседи подсчитываются во всех направлениях. Число соседей внутреннего атома называется объемным координационным числом . Для поверхностей число соседей более ограничено, поэтому поверхностное координационное число меньше объемного координационного числа. Часто поверхностное координационное число неизвестно или переменно. [9] Координационное число поверхности также зависит от индексов Миллера поверхности. В объемно-центрированном кубическом кристалле (BCC) объемное координационное число равно 8, тогда как для поверхности (100) поверхностное координационное число равно 4. [10]
Распространенным способом определения координационного числа атома является рентгеновская кристаллография . Связанные методы включают дифракцию нейтронов или электронов . [11] Координационное число атома можно определить непосредственно путем подсчета ближайших соседей.
α-Алюминий имеет правильную кубическую плотноупакованную структуру, ГЦК , где каждый атом алюминия имеет 12 ближайших соседей, 6 в одной плоскости и 3 сверху и снизу, а координационный полиэдр представляет собой кубооктаэдр . α-Железо имеет объемноцентрированную кубическую структуру, где каждый атом железа имеет 8 ближайших соседей, расположенных в углах куба.

Два наиболее распространенных аллотропа углерода имеют разные координационные числа. В алмазе каждый атом углерода находится в центре правильного тетраэдра , образованного четырьмя другими атомами углерода, координационное число равно четырем, как и у метана. Графит состоит из двумерных слоев, в которых каждый углерод ковалентно связан с тремя другими атомами углерода; атомы в других слоях находятся дальше и не являются ближайшими соседями, что дает координационное число 3. [12]

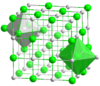
Для химических соединений с регулярной решеткой, таких как хлорид натрия и хлорид цезия , подсчет ближайших соседей дает хорошее представление об окружении ионов. В хлориде натрия каждый ион натрия имеет 6 ионов хлорида в качестве ближайших соседей (в 276 часов) в углах октаэдра, а каждый ион хлорида имеет 6 атомов натрия (также в 276 часов) в углах октаэдра. В хлориде цезия каждый цезий имеет 8 ионов хлорида (в 356 часов), расположенных в углах куба, и каждый хлорид имеет восемь ионов цезия (также в 356 часов) в углах куба.
В некоторых соединениях связи металл-лиганд не все могут находиться на одинаковом расстоянии. Например, в PbCl 2 координационное число Pb 2+ может быть равно семи или девяти, в зависимости от того, какие хлориды относятся к лигандам. Семь хлоридных лигандов имеют расстояния Pb-Cl 280–309 пм. Два хлоридных лиганда более удалены: расстояние Pb-Cl составляет 370 пм. [13]
В некоторых случаях используется другое определение координационного числа, которое включает атомы, находящиеся на большем расстоянии, чем ближайшие соседи. Очень широкое определение, принятое Международным союзом кристаллографии (IUCR), гласит, что координационное число атома в кристаллическом твердом теле зависит от модели химической связи и способа расчета координационного числа. [14] [15]
Некоторые металлы имеют неправильную структуру. Например, цинк имеет искаженную гексагональную плотноупакованную структуру. Регулярная плотная гексагональная упаковка сфер предсказывает, что каждый атом имеет 12 ближайших соседей и координационный многогранник треугольного ортобикупола (также называемого антикубооктаэдром или сдвоенным кубооктаэдром). [12] [16] У цинка есть только 6 ближайших соседей в 266 часов вечера в одной и той же плотноупакованной плоскости с шестью другими, следующими за ними соседями, равноудаленными, по три в каждой из плотноупакованных плоскостей сверху и снизу в 291 час. Считается разумным описывать координационное число как 12, а не как 6. [15] Аналогичные соображения можно применить к регулярной объемноцентрированной кубической структуре, где помимо 8 ближайших соседей есть еще 6, примерно на 15% более удаленных, [12] и в этом случае координационным числом часто считают 14.
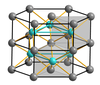
Многие химические соединения имеют искаженную структуру. Арсенид никеля , NiAs, имеет структуру, в которой атомы никеля и мышьяка расположены 6-координатно. В отличие от хлорида натрия, где ионы хлорида имеют кубическую плотную упаковку, анионы мышьяка имеют гексагональную плотную упаковку. Ионы никеля имеют 6-координатную структуру с искаженным октаэдрическим координационным многогранником, в котором столбцы октаэдров имеют противоположные грани. Ионы мышьяка не координированы октаэдрически, а имеют тригонально-призматический координационный полиэдр. Следствием такого расположения является то, что атомы никеля расположены довольно близко друг к другу. Другими соединениями, которые разделяют эту или близкородственную структуру, являются некоторые сульфиды переходных металлов, такие как FeS и CoS , а также некоторые интерметаллиды. В теллуриде кобальта (II) CoTe шесть атомов теллура и два атома кобальта равноудалены от центрального атома Co. [12]
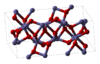
Двумя другими примерами часто встречающихся химических веществ являются Fe 2 O 3 и TiO 2 . Fe 2 O 3 имеет кристаллическую структуру, которую можно описать как имеющую почти плотно упакованный массив атомов кислорода с атомами железа, заполняющими две трети октаэдрических отверстий. Однако у каждого атома железа есть 3 ближайших соседа и еще 3 чуть дальше. Структура довольно сложная, атомы кислорода координированы с четырьмя атомами железа, а атомы железа, в свою очередь, делят вершины, ребра и грани искаженных октаэдров. [12] TiO 2 имеет рутиловую структуру. Атомы титана 6-координатны, 2 атома в 198,3 пм и 4 в 194,6 пм, в слегка искаженном октаэдре. Октаэдры вокруг атомов титана имеют общие ребра и вершины, образуя трехмерную сеть. Ионы оксида имеют 3-координатную тригональную плоскую конфигурацию. [17]


Координационное число систем с беспорядком точно определить невозможно.
Первое координационное число можно определить с помощью функции радиального распределения g ( r ): [18] [19]
Аналогично определяется второе координационное число :
Альтернативные определения координационного числа можно найти в литературе, но суть одна и та же. Одно из таких определений следующее: Обозначая положение первого пика как r p ,
Первая координационная оболочка представляет собой сферическую оболочку радиусом от r 0 до r 1 вокруг исследуемой центральной частицы. [20] [21]