Сопряженная кислота , в рамках кислотно-основной теории Бренстеда-Лоури , представляет собой химическое соединение, образующееся, когда кислота отдает протон ( H + ) основанию — другими словами, это основание с добавленным к нему ионом водорода , как он теряет ион водорода в обратной реакции. С другой стороны, сопряженное основание — это то, что остается после того, как кислота отдала протон во время химической реакции. Следовательно, сопряженное основание — это вещество, образующееся при отрыве протона от кислоты, поскольку в обратной реакции оно может получить ион водорода. [1] Поскольку некоторые кислоты могут давать несколько протонов, сопряженное основание кислоты само по себе может быть кислым.
Кратко это можно представить в виде следующей химической реакции :
Йоханнес Николаус Брёнстед и Мартин Лоури представили теорию Брёнстеда-Лоури, согласно которой любое соединение, которое может отдать протон другому соединению, является кислотой, а соединение, которое принимает протон, является основанием. Протон — это субатомная частица в ядре с единичным положительным электрическим зарядом. Он обозначается символом H + , поскольку имеет ядро из атома водорода , [2] то есть катиона водорода .
Катион может быть сопряженной кислотой, а анион может быть сопряженным основанием, в зависимости от того, какое вещество участвует и какая кислотно-основная теория используется. Простейшим анионом, который может быть сопряженным основанием, является свободный электрон в растворе, сопряженной кислотой которого является атомарный водород.
В кислотно-основной реакции кислота и основание реагируют с образованием сопряженного основания и сопряженной кислоты соответственно. Кислота теряет протон, а основание приобретает протон. На диаграммах, которые это указывают, новая связь, образующаяся между основанием и протоном, показана стрелкой, которая начинается на электронной паре основания и заканчивается на ионе водорода (протоне), который будет перенесен: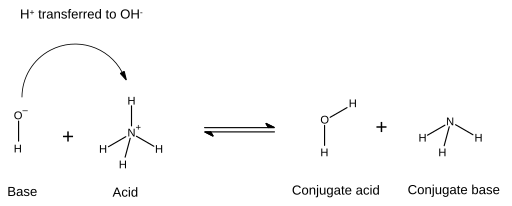 В данном случае молекула воды представляет собой кислоту, сопряженную с основным гидроксид-ионом после того, как последний получил ион водорода от аммония . С другой стороны, аммиак является сопряженным основанием для кислого аммония после того, как аммоний отдал ион водорода для образования молекулы воды. Кроме того, OH - можно рассматривать как сопряженное основание H.
В данном случае молекула воды представляет собой кислоту, сопряженную с основным гидроксид-ионом после того, как последний получил ион водорода от аммония . С другой стороны, аммиак является сопряженным основанием для кислого аммония после того, как аммоний отдал ион водорода для образования молекулы воды. Кроме того, OH - можно рассматривать как сопряженное основание H.
2O , поскольку молекула воды отдает протон, образуя NH+
4в обратной реакции. Термины «кислота», «основание», «сопряженная кислота» и «сопряженное основание» не являются фиксированными для определенного химического вещества, но могут быть заменены местами, если протекающая реакция обращена вспять.
Сила сопряженной кислоты пропорциональна ее константе расщепления . Более сильная сопряженная кислота будет легче расщепляться на продукты, «отталкивать» протоны водорода и иметь более высокую константу равновесия . Силу сопряженного основания можно рассматривать как его склонность «притягивать» протоны водорода к себе. Если сопряженное основание классифицируется как сильное, оно будет «удерживать» протон водорода при растворении, и его кислота не будет расщепляться.
Если химическое вещество является сильной кислотой, сопряженное с ним основание будет слабым. [3] Примером этого случая может быть расщепление соляной кислоты HCl в воде. Поскольку HCl является сильной кислотой (она в значительной степени расщепляется), то сопряженное с ней основание ( Cl−
) будет слабым. Следовательно, в этой системе большинство H+
будут ионы гидроксония H
3О+
вместо того, чтобы присоединяться к анионам Cl - , и сопряженные основания будут слабее молекул воды.
С другой стороны, если химическое вещество представляет собой слабую кислоту, его сопряженное основание не обязательно будет сильным. Учтите, что этаноат, сопряженное основание этаноловой кислоты, имеет константу расщепления основания (Kb) примерно5,6 × 10-10 , что делает его слабым основанием. Чтобы вид имел сильное сопряженное основание, он должен быть очень слабой кислотой, например водой.
Чтобы идентифицировать сопряженную кислоту, найдите пару родственных соединений. Кислотно -основную реакцию можно рассматривать в смысле «до» и «после». То, что было раньше, — это реагентная часть уравнения, а то, что было после, — это часть уравнения, соответствующая продукту. Сопряженная кислота в последней части уравнения получает ион водорода, поэтому в передней части уравнения соединение, у которого на один ион водорода меньше, чем в сопряженной кислоте, является основанием. Сопряженное основание в последней части уравнения потеряло ион водорода, поэтому в передней части уравнения соединение, которое имеет еще один ион водорода сопряженного основания, является кислотой.
Рассмотрим следующую кислотно-основную реакцию:
Азотная кислота ( HNO
3) является кислотой , поскольку она отдает протон молекуле воды, а ее сопряженное основание представляет собой нитрат ( NO−
3). Молекула воды действует как основание, поскольку она принимает катион водорода (протон), а ее сопряженная кислота представляет собой ион гидроксония ( H
3О+
).
Одно из применений сопряженных кислот и оснований заключается в буферных системах, которые включают буферный раствор . В буфере используются слабая кислота и сопряженное с ней основание (в форме соли) или слабое основание и сопряженная с ним кислота, чтобы ограничить изменение pH в процессе титрования. Буферы имеют как органическое, так и неорганическое химическое применение. Например, помимо буферов, используемых в лабораторных процессах, человеческая кровь действует как буфер для поддержания pH. Самым важным буфером в нашем кровотоке является углекислотно-бикарбонатный буфер , который предотвращает резкие изменения pH при воздействии CO .
2вводится. Это функционирует следующим образом:
Кроме того, вот таблица общих буферов.
Вторым распространенным применением органических соединений является производство буфера с уксусной кислотой. Если уксусная кислота, то слабая кислота с формулой CH
3COOH был превращен в буферный раствор, его необходимо было объединить с сопряженным основанием CH.
3главный операционный директор−
в виде соли. Полученная смесь называется ацетатным буфером, состоящим из водного CH .
3COOH и водный CH
3КУНа . Уксусная кислота, наряду со многими другими слабыми кислотами, служит полезными компонентами буферов в различных лабораторных условиях, каждая из которых полезна в своем диапазоне pH.
Раствор лактата Рингера является примером того, как сопряженное основание органической кислоты, молочной кислоты , CH
3СН(ОН)СО−
2соединяется с катионами натрия, кальция и калия и анионами хлорида в дистиллированной воде [4] , которые вместе образуют жидкость, изотоническую по отношению к крови человека и используемую для жидкостной реанимации после кровопотери вследствие травмы , хирургического вмешательства или ожога. . [5]
Ниже приведены несколько примеров кислот и соответствующих им сопряженных оснований; обратите внимание, как они отличаются всего на один протон (ион H + ). Сила кислоты уменьшается, а сила сопряженных оснований увеличивается по таблице.
Напротив, вот таблица оснований и сопряженных с ними кислот. Аналогично, сила основания уменьшается, а сила сопряженной кислоты увеличивается вниз по таблице.