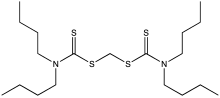
В органической химии дитиокарбамат — функциональная группа с общей формулой R2N −C(=S)−S−R и структурой >N−C(=S)−S− . Это аналог карбамата , в котором оба атома кислорода заменены атомами серы (при замене только одного атома кислорода получается тиокарбамат ).
Дитиокарбамат также относится к иону дитиокарбамата R 2 N−CS−2и его соли. Типичным примером является диэтилдитиокарбамат натрия . Дитиокарбаматы и их производные широко используются при вулканизации резины. [1]
Многие вторичные амины реагируют с сероуглеродом и гидроксидом натрия с образованием дитиокарбаматных солей: [2]
Аммиак реагирует с CS 2 аналогично:
Дитиокарбаматные соли — бледно-окрашенные твердые вещества, растворимые в воде и полярных органических растворителях.
Первичный амин и сероуглерод реагируют с образованием дитиокарбаминовой кислоты :
В присутствии диимидов или пиридина эти кислоты превращаются в изотиоцианаты : [3]
Дитиокарбаматы легко S-алкилируются. Таким образом, метилдиметилдитиокарбамат может быть получен метилированием дитиокарбамата: [4]
Окисление дитиокарбаматов дает дисульфид тиурама :
Дисульфиды тиурама реагируют с реактивами Гриньяра, образуя эфиры дитиокарбаминовой кислоты: [5]
Дитиокарбаматы реагируют с солями переходных металлов, образуя широкий спектр комплексов дитиокарбаматов переходных металлов .
Дитиокарбаматы описываются с помощью резонансных структур, которые подчеркивают пи-донорные свойства аминогруппы. Это связывающее расположение указывается коротким расстоянием C–N и копланарностью ядра NCS 2 , а также атомов, присоединенных к N. [6]

Из-за пи-донорства от азота дитиокарбаматы являются более основными, чем структурно родственные анионы, такие как дитиокарбоксилаты и ксантогенаты . Следовательно, они имеют тенденцию связываться как бидентатные лиганды. Другим следствием множественной связи C–N является то, что вращение вокруг этой связи подвержено высокому барьеру.
Несколько комплексов дитиокарбаматов переходных металлов полезны в промышленности. Дитиокарбаматы цинка используются для модификации сшивания некоторых полиолефинов с серой, процесс называется вулканизацией . Они используются в качестве лигандов для хелатирования металлов. [7]

Некоторые дитиокарбаматы, в частности этиленбисдитиокарбаматы (EBDC ), в форме комплексов с марганцем ( манеб ), цинком ( зинеб ) или комбинацией марганца и цинка ( манкоцеб ), широко использовались в качестве фунгицидов в сельском хозяйстве с 1940-х годов. [8] В Соединенных Штатах они начали регистрироваться для использования в конце 1950-х и начале 1960-х годов и были быстро введены в действие против сажистых пятен и мухоморовых пятен . [9] Многие производители перешли с каптана на EBDC для более длительного остаточного периода. [9] И каптан, и EBDC были основными методами лечения SBFS в этой стране до начала 1990-х годов, когда Агентство по охране окружающей среды США запретило EBDC в течение 77 дней до сбора урожая. [9] Это фактически сделало летнее использование невозможным, сократило использование EBDC в целом и радикально увеличило SBFS. [9]