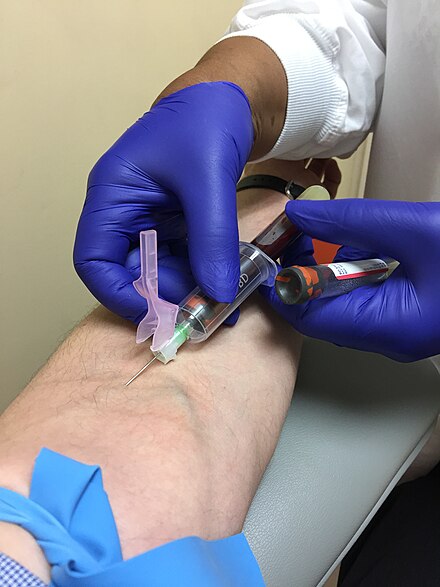
В медицине венепункцией или венепункцией называется процесс получения внутривенного доступа с целью забора венозной крови (также называемой флеботомией ) или внутривенной терапии . В здравоохранении эта процедура выполняется учеными медицинских лабораторий , врачами-практиками , некоторыми фельдшерами , фельдшерами , флеботомистами , специалистами по диализу и другим сестринским персоналом. [1] В ветеринарии эта процедура выполняется ветеринарами и ветеринарными специалистами .
Важно следовать стандартной процедуре сбора образцов крови, чтобы получить точные результаты лабораторных исследований. Любая ошибка при сборе крови или заполнении пробирок может привести к ошибочным результатам лабораторных исследований. [2]
Венепункции являются одной из наиболее часто выполняемых инвазивных процедур и проводятся по одной из пяти причин:
Анализ крови является важным диагностическим инструментом, доступным врачам здравоохранения.
Кровь чаще всего берут из поверхностных вен верхней конечности. [1] Срединная локтевая вена , которая лежит в локтевой ямке спереди от локтя, находится близко к поверхности кожи без множества крупных нервов, расположенных поблизости. Другие вены, которые могут быть использованы в локтевой ямке для венепункции, включают головную , базиликовую и срединную предплечье вены . [4]
Небольшие количества крови можно брать из пальца , а у младенцев — из пятки или из вены головы с помощью иглы-крылышки .
Флеботомия (рассечение вены) также является методом лечения некоторых заболеваний, таких как гемохроматоз , первичная и вторичная полицитемия .
Исследование, проведенное в 1996 году среди доноров крови (при сдаче крови используется игла большего размера, чем при обычной венепункции), показало, что у 1 из 6300 доноров наблюдалось повреждение нерва. [5]
Риск и побочные эффекты могут включать в себя множество вещей. Головокружение, потливость, а также снижение частоты сердечных сокращений и артериального давления. [1] [6]

Существует много способов взятия крови из вены, и выбор метода зависит от возраста человека, имеющегося оборудования и типа требуемых анализов.
Большая часть сбора крови в США, Великобритании, Канаде и Гонконге осуществляется с помощью системы вакуумных трубок. Две распространенные системы — Vacutainer (Becton, Dickinson and company) и Vacuette (Greiner Bio-One). Оборудование состоит из пластикового адаптера, также известного как держатель/концентратор трубки или иглы, иглы для подкожных инъекций и вакуумной трубки. При определенных обстоятельствах может использоваться шприц, часто с иглой- бабочкой , которая представляет собой пластиковый катетер, прикрепленный к короткой игле. В развивающихся странах система вакуумных трубок является предпочтительным методом забора крови. [ необходима цитата ]

Компания Greiner Bio-One изготовила первую в мире пластиковую вакуумную пробирку для сбора крови в 1985 году под торговой маркой VACUETTE. Сегодня многие компании продают вакуумные пробирки, поскольку патент на это устройство теперь находится в открытом доступе. Эти пробирки производятся с определенным объемом газа, удаленным из запечатанной пробирки. Когда игла из концентратора или устройства для переноса вставляется в пробку, вакуум пробирки автоматически втягивает требуемый объем крови. [ необходима цитата ]
Базовая система вакуумных трубок (ETS) состоит из иглы, держателя трубок и вакуумных трубок. Игла прикрепляется к держателю трубок флеботомистом перед сбором или может поставляться производителем как единое целое. Игла выступает через конец держателя трубок и имеет иглу на каждом конце. После предварительной очистки места венепункции и наложения жгута флеботомист снимает колпачок с иглы, прикрепленной к держателю трубок, вставляет иглу в вену, затем вставляет вакуумные трубки в держатель трубок, где пробка трубки прокалывается задним концом иглы. Затем вакуум в трубке автоматически забирает необходимую кровь непосредственно из вены. Несколько вакуумных трубок можно по очереди прикреплять и снимать с одной иглы, что позволяет получать несколько образцов в ходе одной процедуры. Это возможно благодаря многоразовому рукаву для образцов, который представляет собой гибкий резиновый фитинг над задним концом канюли иглы, который герметизирует иглу, пока она не будет вытолкнута в сторону. Это препятствует свободному вытеканию крови из задней части иглы, вставленной в вену, по мере того, как каждая пробирка удаляется, а следующая прокалывается. Правила безопасности OSHA требуют, чтобы иглы или держатели пробирок были оснащены защитным устройством, закрывающим иглу после процедуры, чтобы предотвратить случайную травму от укола иглой. [7]
Также имеются в наличии фитинги и адаптеры, используемые для заполнения вакуумных трубок из наборов игл-бабочек и шприцев. [ необходима ссылка ]
Существует несколько калибров игл, из которых может выбирать флеботомист. Наиболее часто используются следующие: игла 21 г (зеленый верх), игла 22 г (черный верх), игла-бабочка 21 г (зеленая этикетка), игла-бабочка 23 г (голубая этикетка) и игла-бабочка 25 г (оранжевая или темно-синяя этикетка) (однако эта игла используется только в педиатрии или в крайних случаях, поскольку она настолько мала, что часто может приводить к гемолизу образца крови). Также существуют различные размеры и объемы пробирок и бутылок для различных требований к тестам. [8]
Пробирки, в которые собирается кровь, могут содержать одну или несколько добавок. Как правило, тесты, требующие цельной крови, требуют образцов крови, собранных в пробирках, содержащих некоторую форму антикоагулянта ЭДТА . ЭДТА хелатирует кальций, предотвращая свертывание. ЭДТА предпочтительна для гематологических тестов, поскольку она наносит минимальный ущерб морфологии клеток. Цитрат натрия является антикоагулянтом, используемым в образцах, собранных для тестов на коагуляцию. Большинство химических и иммунологических тестов проводятся на сыворотке, которая производится путем свертывания и последующего разделения образца крови с помощью центрифуги. Эти образцы собираются либо в пробирку без добавок, либо в пробирку, содержащую активатор свертывания . Этот активатор свертывания может мешать некоторым анализам , поэтому в этих случаях рекомендуется использовать простую пробирку, но это задержит тестирование. Пробирки, содержащие литий-гепарин или натрий-гепарин, также обычно используются для различных химических тестов, поскольку они не требуют свертывания и могут быть центрифугированы сразу после сбора. Для тестов на глюкозу используется комбинация фторида натрия и оксалата калия, поскольку эти добавки предотвращают свертывание и останавливают гликолиз, благодаря чему уровень глюкозы в крови сохраняется после сбора. [9] Другая специальная пробирка — непрозрачная пробирка янтарного цвета, используемая для сбора крови для анализа светочувствительных веществ, таких как билирубин . [ требуется ссылка ]
Пробирки маркируются добавкой, которую они содержат, но пробка на каждой пробирке также имеет цветовую кодировку в соответствии с добавкой. Хотя цвета различаются у разных производителей, цвета пробки, как правило, связаны с каждой добавкой, как указано ниже. Поскольку добавки из каждой пробирки могут оставаться на игле, используемой для заполнения пробирок, их необходимо набирать в определенном порядке, чтобы гарантировать, что перекрестное загрязнение не окажет отрицательного влияния на тестирование образцов, если одновременно набираются несколько пробирок. «Порядок взятия пробы» зависит от метода сбора. Ниже в порядке взятия пробы, обычно требуемом для метода сбора Evacuated Tube System (ETS), приведены наиболее распространенные пробирки с указанием добавки и цвета: [10] [11]
Использование ионофореза лидокаина эффективно для уменьшения боли и облегчения стресса во время венепункции у детей. [19] Было показано, что система доставки порошка лидокаина без иглы уменьшает боль при венепункции у детей. [20] [21] Быстрой дермальной анестезии можно добиться путем местной инфильтрации анестетика, но это может вызвать беспокойство у детей, испуганных иглами, или деформировать кожу, что затрудняет сосудистый доступ и увеличивает риск воздействия игл на работников здравоохранения. Дермальной анестезии также можно добиться без игл путем местного нанесения местных анестетиков или ионофореза лидокаина. Напротив, неинвазивная дермальная анестезия может быть установлена в течение 5–15 минут без деформации подлежащих тканей с помощью ионофореза лидокаина, где постоянный электрический ток облегчает проникновение в кожу положительно заряженных молекул лидокаина при помещении под положительный электрод. [ необходима цитата ]
В одном исследовании сделан вывод о том, что ионтофоретическое введение лидокаина безопасно и эффективно для обеспечения дермальной анестезии при венепункции у детей 6–17 лет. Эта методика может быть не применима ко всем детям. Будущие исследования могут предоставить информацию о минимальной эффективной ионтофоретической дозе для дермальной анестезии у детей и сравнение анестезирующей эффективности и удовлетворенности ионтофорезом лидокаина с местными анестетическими кремами и подкожной инфильтрацией. [19]
Нефармакологическое лечение боли, связанной с венепункцией у детей, включает гипноз и отвлечение. Эти методы лечения уменьшили сообщаемую самим пациентом боль, а в сочетании с когнитивно-поведенческой терапией (КПТ) уменьшение боли было еще больше. Другие вмешательства не были признаны эффективными, и это внушение, выдувание воздуха и отвлечение с родительским коучингом, которые не отличались от контроля боли и дистресса. [22]
Некоторые работники здравоохранения предпочитают использовать технику шприца -иглы для венепункции. Sarstedt производит систему забора крови (S-Monovette), которая использует этот принцип. [23] Этот метод может быть предпочтительным для пожилых людей, больных раком, с тяжелыми ожогами, ожирением или в случаях, когда вены ненадежны или хрупки. Поскольку шприцы управляются вручную, величину применяемого отсасывания можно легко контролировать. Это особенно полезно, когда вены маленькие и могут спадаться под действием отсасывающей трубки. У детей или в других случаях, когда количество получаемой крови может быть ограничено, может быть полезно знать, сколько крови можно получить, прежде чем распределять ее между различными добавками, которые потребуются в лаборатории. Другой альтернативой является забор крови из постоянных канюль. [24]
Бывают случаи, когда требуется сбор культуры крови. Культура определит, есть ли в крови патогены. Обычно кровь стерильна. При заборе крови из культур используйте стерильный раствор, такой как бетадин, а не спирт . Это делается с использованием стерильных перчаток, не вытирая хирургический раствор, не касаясь места прокола и не нарушая каким-либо образом стерильность процесса. Крайне важно, чтобы процедура проводилась максимально стерильно, поскольку постоянное присутствие комменсалов кожи в культурах крови может указывать на эндокардит , но чаще всего они встречаются в качестве загрязнителей. Рекомендуется использовать абразивный метод подготовки кожи. Это удаляет верхние слои омертвевших клеток кожи вместе с их загрязняющими бактериями. [25] Традиционно использовался повидон-йод, но в Великобритании предпочтительнее использовать 2% раствор хлоргексидина в 70% растворе этанола или изопропилового спирта, и необходимо дать время, чтобы он высох. Верхние части любых контейнеров, используемых при заборе крови для посева, также следует дезинфицировать с помощью аналогичного раствора. Некоторые лаборатории активно не рекомендуют использовать йод, так как считается, что йод разрушает резиновую пробку, через которую кровь попадает в бутылку, тем самым позволяя загрязняющим веществам проникать в контейнер. [ необходима цитата ]
Кровь собирается в специальные транспортные бутылки, которые похожи на вакуумные трубки, но имеют другую форму. Бутылка для культивирования крови содержит транспортную среду для сохранения любых присутствующих микроорганизмов во время их транспортировки в лабораторию для культивирования. Поскольку неизвестно, являются ли патогены анаэробными (живущими без кислорода) или аэробными (живущими с кислородом), кровь собирается для проверки на оба типа. Сначала заполняется аэробная бутылка, а затем анаэробная бутылка. Однако, если сбор выполняется с помощью шприца, сначала заполняется анаэробная бутылка. Если используется набор для сбора бабочки, сначала заполняется аэробная бутылка, так что весь воздух в трубке выпускается в бутылку, содержащую кислород. [ необходима цитата ]
Специально разработанные бутылки для сбора крови устраняют необходимость в методе забора крови с помощью шприца или бабочки. Эти специально разработанные бутылки имеют длинные горлышки, которые подходят для держателей вакуумных трубок, используемых для обычного сбора венепункции. Эти бутылки также позволяют собирать другие образцы крови с помощью вакуумных трубок, которые собираются без дополнительной венепункции. [ необходима цитата ]
Количество собираемой крови имеет решающее значение для оптимального восстановления микроорганизмов. Обычно берут до 10 мл крови, но оно может варьироваться в зависимости от рекомендаций производителя бутылки для сбора. У младенцев и детей берут от 1 до 5 мл. Если собрать слишком мало крови, соотношение крови и питательного бульона будет подавлять рост микроорганизмов. Если собрать слишком много крови, существует риск анемии, вызванной больницей, а соотношение крови и питательного бульона будет отклоняться в противоположном направлении, что также не способствует оптимальному росту. [ необходима цитата ]
Затем бутылки инкубируют в специализированных установках в течение 24 часов, прежде чем лаборант изучает и/или тестирует их. Этот шаг позволяет очень небольшому количеству бактерий (потенциально 1 или 2 организма) размножаться до уровня, достаточного для идентификации +/-тестирования устойчивости к антибиотикам. Современные бутылки для гемокультуры имеют индикатор в основании, который меняет цвет в присутствии роста бактерий и может автоматически считываться машиной. (По этой причине наклейки со штрих-кодом, находящиеся на этих бутылках, не следует удалять, поскольку они используются автоматизированными системами лаборатории.) [ необходима цитата ]
Образцы крови от живых лабораторных животных можно собирать следующими методами: [26] [27]
Объем взятия образца крови очень важен у экспериментальных животных. Все нетерминальные взятия крови без замены жидкостей ограничены до 10% от общего объема циркулирующей крови у здоровых, нормальных, взрослых животных за один раз, и взятие может быть повторено через три-четыре недели. В случае, если требуются повторные взятия образцов крови с короткими интервалами, максимум 0,6 мл/кг/день или 1,0% от общего объема крови животного можно забирать каждые 24 часа. Расчетный объем крови у взрослых животных составляет от 55 до 70 мл/кг массы тела. Следует проявлять осторожность в отношении пожилых и тучных животных. Если объем взятия крови превышает более 10% от общего объема крови, может потребоваться замена жидкости. Национальные институты здравоохранения (NIH) рекомендуют раствор Рингера с лактатом (LRS) в качестве лучшей замены жидкости. Если объем взятия крови превышает более 30% от общего объема циркулирующей крови, следует принять соответствующие меры, чтобы у животного не развилась гиповолемия. [27]
Обычно не рекомендуется использовать изопропиловый спирт для очистки места венепункции при получении образца для анализа крови на алкоголь . Это было связано в основном с потенциальными правовыми последствиями, связанными с использованием очистителей на основе спирта, которые теоретически могут повлиять на анализ. Было выпущено множество наборов для сбора алкоголя полицией, которые включают консервант фторид натрия/оксалат калия и очищающие средства на неспиртовой основе для обеспечения надлежащего сбора. Использование мыла и горячей воды или тампона с повидон-йодом являются рекомендуемыми альтернативами изопропиловому спирту в этом случае. [ необходима цитата ]