Полигалогеновые ионы — это группа многоатомных катионов и анионов , содержащих только галогены . Ионы можно разделить на два класса: изополигалогеновые ионы, содержащие только один тип галогена, и гетерополигалогеновые ионы, содержащие более одного типа галогена.
Были обнаружены многочисленные полигалогеновые ионы, их соли были выделены в твердом состоянии и структурно охарактеризованы. В следующих таблицах обобщены известные виды. [1] [2] [3] [4] [5] [6]
* [Cl 2 ] + может существовать только как [Cl 2 O 2 ] 2+ при низких температурах, комплекс с переносом заряда от O 2 к [Cl 2 ] + . [2] Свободный [Cl 2 ] + известен только из его электронного зонного спектра, полученного в разрядной трубке низкого давления. [3]
† Существование [I 7 ] + возможно, но все еще неопределенно. [1]

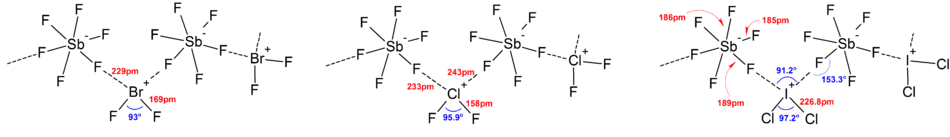

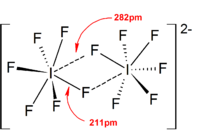
Большинство структур ионов были определены с помощью ИК-спектроскопии , Рамановской спектроскопии и рентгеновской кристаллографии . Полигалогеновые ионы всегда имеют самый тяжелый и наименее электроотрицательный галоген, присутствующий в ионе в качестве центрального атома, что делает ион асимметричным в некоторых случаях. Например, [Cl 2 F] + имеет структуру [Cl−Cl−F] − , но не [Cl−F−Cl] − .
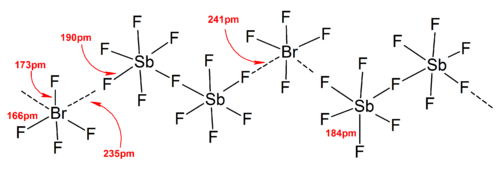
В целом структуры большинства гетерополигалогеновых ионов и низших изополигалогеновых ионов согласуются с моделью VSEPR . Однако были и исключительные случаи. Например, когда центральный атом тяжелый и имеет семь неподеленных пар , таких как [BrF 6 ] − и [IF 6 ] − , они имеют правильное октаэдрическое расположение фторидных лигандов вместо искаженного из-за наличия стереохимически инертной неподеленной пары . Больше отклонений от идеальной модели VSEPR было обнаружено в твердотельных структурах из-за сильных взаимодействий катион-анион, что также усложняет интерпретацию колебательных спектроскопических данных. Во всех известных структурах солей полигалогеновых анионов анионы очень тесно контактируют через галогенные мостики с противокатионами. [4] Например, в твердом состоянии [IF 6 ] − не является регулярно октаэдрическим, поскольку структура твердого состояния [(CH 3 ) 4 N] + [IF 6 ] − показывает слабосвязанные димеры [I 2 F 11 ] 2− . Значительные взаимодействия катионов и анионов были также обнаружены в [BrF 2 ] + [SbF 6 ] − , [ClF 2 ] + [SbF 6 ] − , [BrF 4 ] + [Sb 6 F 11 ] − . [2]
‡ [IF 5 ] 2− — один из двух видов XY n -типа, известный своей редкой пентагональной плоской геометрией, другой — [XeF 5 ] − .
¶ [ClF 6 ] − имеет искаженную октаэдрическую структуру, поскольку стереохимический эффект инертной пары в атоме хлора незначителен.
Ионы [I 3 Cl 2 ] + и [I 3 Br 2 ] + имеют структуру транс - Z -типа, аналогичную структуре [I 5 ] + .
Полииодидные ионы имеют гораздо более сложную структуру. Дискретные полииодиды обычно имеют линейную последовательность атомов иодида и ионов и описываются в терминах ассоциации между единицами I 2 , I − и [I 3 ] − , что отражает происхождение полииодида. В твердых состояниях полииодиды могут взаимодействовать друг с другом, образуя цепи, кольца или даже сложные двумерные и трехмерные сети.
Связывание в ионах полигалогенов в основном вызывает преобладающее использование p-орбиталей. Значительное участие d-орбитали в связывании маловероятно, поскольку потребуется много энергии продвижения, в то время как скудное участие s-орбитали ожидается в йодсодержащих видах из-за эффекта инертной пары , что предполагается данными мессбауэровской спектроскопии . Однако ни одна модель связывания не была способна воспроизвести такой широкий диапазон длин связей и углов, наблюдаемых до сих пор. [3]
Как и ожидалось из того факта, что электрон удаляется из антисвязывающей орбитали при ионизации X 2 до [X 2 ] + , порядок связи , а также прочность связи в [X 2 ] + становятся выше, следовательно, межатомные расстояния в молекулярном ионе меньше, чем в X 2 .
Линейные или почти линейные трехатомные полигалогениды имеют более слабые и длинные связи по сравнению с соответствующими двухатомными интергалогенами или галогенами, что согласуется с дополнительным отталкиванием между атомами при добавлении галогенидного иона к нейтральной молекуле. Существует еще одна модель, включающая использование теории резонанса , например, [ICl 2 ] − можно рассматривать как резонансный гибрид следующих канонических форм :

Доказательства, подтверждающие эту теорию, получены из длин связей (255 пм в [ICl 2 ] − и 232 пм в ICl (г)) и волновых чисел растяжения связей (267 и 222 см −1 для симметричного и асимметричного растяжения в [ICl 2 ] − по сравнению с 384 см −1 в ICl), что предполагает порядок связи около 0,5 для каждой связи I–Cl в [ICl 2 ] − , что согласуется с интерпретацией с использованием теории резонанса. Другие трехатомные виды [XY 2 ] − могут быть интерпретированы аналогичным образом. [2]
Несмотря на то, что они имеют пониженный порядок связи, все три атома галогена тесно связаны. Связь фтора-фтора трифторида с порядком связи 0,5 имеет прочность связи 30 ккал/моль, всего на 8 ккал/моль меньше, чем связь фтора-фтора в дифторе, порядок связи которого равен 1. [7]
Образование полигалогеновых ионов можно рассматривать как самодиссоциацию их родительских интергалогенов или галогенов :
Существуют две общие стратегии получения полигалогеновых катионов:
В некоторых случаях кислота Льюиса ( акцептор фторида ) сама действует как окислитель:
Обычно первый метод используется для получения гетерополигалогеновых катионов, а второй применим к обоим. Окислительный процесс полезен при получении катионов [IBr 2 ] + , [ClF 6 ] + , [BrF 6 ] + , поскольку их родительские интергалогены, IBr 3 , ClF 7 , BrF 7 соответственно, никогда не были выделены:
Подготовка некоторых отдельных видов кратко изложена в таблице ниже с уравнениями: [1] [2] [3] [4]
‡ В этой реакции активным окислителем является [NiF 3 ] + , который образуется in situ в системе Cs 2 [NiF 6 ] / AsF 5 /HF. Он является еще более мощным окислителем и фторирующим агентом, чем PtF 6 .
Для полигалогеновых анионов также существуют две общие стратегии получения:
Подготовка некоторых отдельных видов кратко изложена в таблице ниже с уравнениями: [1] [2] [3] [4]
Высшие полииодиды были образованы при кристаллизации растворов, содержащих различные концентрации I − и I 2 . Например, моногидрат K + [I 3 ] − кристаллизуется при охлаждении насыщенного раствора, содержащего соответствующие количества I 2 и KI . [8] : v1p294
В общем случае большой противокатион или анион (такой как Cs + и [SbF6 ] − ) может помочь стабилизировать полигалогеновые ионы, образующиеся в твердом состоянии, из соображений энергии решетки , поскольку эффективность упаковки увеличивается.
Полигалогеновые катионы являются сильными окислителями, на что указывает тот факт, что их можно приготовить только в окислительных жидкостях в качестве растворителя, например, в олеуме . Наиболее окисляющими и, следовательно, наиболее нестабильными являются виды [X 2 ] + и [XF 6 ] + (X = Cl, Br), за которыми следуют [X 3 ] + и [IF 6 ] + .
Стабильность солей [X 2 ] + (X = Br, I) термодинамически довольно стабильна. Однако их стабильность в растворе зависит от суперкислотного растворителя. Например, [I 2 ] + стабилен во фторсурьмяной кислоте (HF с 0,2 N SbF 5 , H = −20,65), но диспропорционирует с [I 3 ] + , [I 5 ] + и I 2 , когда вместо SbF 5 добавляются более слабые акцепторы фтора, такие как NbF 5 , TaF 5 или NaF . [4]
Для полигалогеновых анионов с одинаковым числом атомов более устойчивыми являются те, в центре которых находится более тяжелый галоген, симметричные ионы также более устойчивы, чем асимметричные. Поэтому устойчивость анионов уменьшается в ряду:
Гетерополигалогеновые ионы с координационным числом больше или равным четырем могут существовать только с фторидными лигандами.
Большинство полигалогеновых ионов интенсивно окрашены, с более глубоким цветом по мере увеличения атомного веса составляющего элемента. Хорошо известный комплекс крахмала с иодом имеет глубокий синий цвет из-за линейных ионов [I 5 ] − , присутствующих в амилозной спирали. [4] Некоторые цвета распространенных видов перечислены ниже: [3]
Катионы гетерополигалогенов являются взрывоопасными реактивными окислителями, и катионы часто имеют более высокую реактивность, чем их родительские интергалогены, и разлагаются восстановительными путями. Как и ожидалось из наивысшей степени окисления +7 в [ClF 6 ] + , [BrF 6 ] + и [IF 6 ] + , эти виды являются чрезвычайно сильными окислителями, что продемонстрировано реакциями, показанными ниже:
Полигалогеновые катионы с более низкими степенями окисления имеют тенденцию к диспропорционированию . Например, [Cl 2 F] + нестабилен в растворе и полностью диспропорционирует в смеси HF/ SbF 5 даже при 197 К:
[I 2 ] + обратимо димеризуется при 193 К, и это наблюдается, когда синий цвет парамагнитного [I 2 ] + резко смещается к красно-коричневому цвету диамагнитного [I 2 ] + , вместе с падением парамагнитной восприимчивости и электропроводности при охлаждении раствора до температуры ниже 193 К: [2]
Димеризацию можно объяснить перекрытием полузаполненных π*-орбиталей в двух [I 2 ] + .
[Cl 4 ] + в [Cl 4 ] + [IrF 6 ] − структурно аналогичен [I 4 ] 2+ , но разлагается при 195 К с образованием Cl 2 и солей [Cl 3 ] + вместо [Cl 2 ] + . [2]
Попытки получить ClF 7 и BrF 7 путем фторирования [ClF 6 ] + и [BrF 6 ] + с использованием NOF потерпели неудачу, поскольку происходили следующие реакции: [3]
Анионы менее реакционноспособны по сравнению с катионами и, как правило, являются более слабыми окислителями, чем их родительские интергалогены. Они менее реакционноспособны по отношению к органическим соединениям, и некоторые соли обладают довольно высокой термической стабильностью. Соли, содержащие полигалогеновые анионы типа M + [X m Y n Z p ] − , где m + n + p = {3, 5, 7, 9...}, имеют тенденцию диссоциировать на простые моногалогенидные соли между M + и наиболее электроотрицательным галогеном, так что моногалогенид имеет самую высокую энергию решетки. Интергалоген обычно образуется как другой продукт. Соль [(CH 3 ) 4 N] + [ClF 4 ] − разлагается при температуре около 100 °C, а соли [ClF 6 ] − термически нестабильны и могут взорваться даже при -31 °C. [4]