
Кинетопласт — это сеть кольцевой ДНК (называемой кДНК) внутри митохондрии , которая содержит множество копий митохондриального генома . [1] [2] Наиболее распространенной структурой кинетопласта является диск, но они наблюдались и в других формах. Кинетопласты встречаются только у Excavata класса Kinetoplastida . Вариативность строения кинетопластов может отражать филогенные взаимоотношения между кинетопластидами. [3] Кинетопласт обычно прилегает к базальному телу жгутика организма , что позволяет предположить, что он связан с некоторыми компонентами цитоскелета . У Trypanosoma brucei это цитоскелетное соединение называется трехсторонним комплексом прикрепления и включает белок p166. [4]
У трипаносом , группы жгутиковых простейших, кинетопласт существует в виде плотной гранулы ДНК внутри митохондрии. Trypanosoma brucei , паразит, вызывающий африканский трипаносомоз (африканскую сонную болезнь), является примером трипаносомы с кинетопластом. Его кинетопласт легко увидеть в образцах , окрашенных DAPI ( флуоресцентное окрашивание ДНК) или с помощью флуоресцентной гибридизации in situ (FISH) с BrdU, аналогом тимидина . [5]
Кинетопласт содержит кольцевую ДНК в двух формах: максикольцах и миникольцах . Размер максикругов составляет от 20 до 40 КБ, а на кинетопласт приходится несколько десятков. В одном кинетопласте содержится несколько тысяч миникружков, размер которых составляет от 0,5 до 1 КБ. Максициклы кодируют типичные белковые продукты, необходимые для митохондрий, которые зашифрованы. В этом заключается единственная известная функция мини-колец — производство направляющей РНК (гРНК) для декодирования этой зашифрованной информации максикольца, обычно посредством вставки или удаления остатков уридина . Сеть макси- и мини-кругов соединены в цепочку , образуя плоскую сеть, напоминающую кольчугу . Воспроизведение этой сети затем требует, чтобы эти кольца были отсоединены от родительского кинетопласта и впоследствии повторно соединены в дочернем кинетопласте. [5] [6] Этот уникальный способ репликации ДНК может вдохновить потенциальных мишеней для лекарств .
Наиболее изученной структурой кДНК является структура Crithidia fasciculata , цепчатый диск из круглых макси- и мини-кольцев кДНК, большинство из которых не являются сверхспиральными . [3] Снаружи от диска кДНК, но непосредственно рядом находятся два комплекса белков, расположенных на расстоянии 180˚ друг от друга и участвующих в репликации мини-кольца. [1] [2] [5] [6]
Также наблюдались вариации сетей кинетопластов, которые описываются расположением и расположением их кДНК.
Наличие такого разнообразия структур кДНК усиливает эволюционное родство между видами кинетопластид. Поскольку пан-кДНК больше всего напоминает ДНК- плазмиду , она может быть предковой формой кДНК. [3]
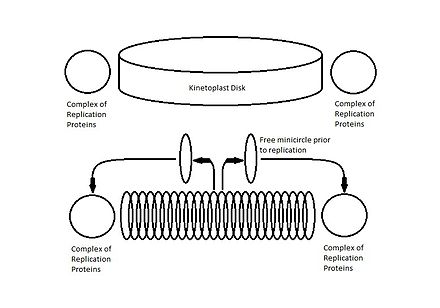
Репликация кинетопласта происходит одновременно с дупликацией соседнего жгутика и непосредственно перед репликацией ядерной ДНК . В традиционной сети кДНК Crithidia fasciculata инициации репликации способствует разъединение мини-колец кДНК с помощью топоизомеразы II . Свободные миникольца высвобождаются в область между кинетопластом и митохондриальной мембраной, называемую кинетофлагеллярной зоной (КФЗ). [2] [3] [6] После репликации миникольца мигрируют неизвестными механизмами к антиподальным белковым комплексам, которые содержат несколько белков репликации, включая эндонуклеазу , хеликазу , ДНК-полимеразу , ДНК-примазу и ДНК-лигазу , которые инициируют восстановление оставшихся разрывов в недавно реплицированные мини-круги. [5]
Этот процесс происходит по одному миникольцу за раз, и лишь небольшое количество миникругов не связаны в любой момент времени. Чтобы отслеживать, какие мини-кольца были реплицированы, после повторного присоединения к сети кДНК в возникающих мини-кольцах остается небольшой пробел, который идентифицирует их как уже реплицированные. Миникольца, которые еще не реплицировались, все еще ковалентно замкнуты. Сразу после репликации каждое потомство прикрепляется к сети кДНК, проксимальной к антиподальным белковым комплексам, и разрывы частично восстанавливаются. [1] [6]


По мере репликации мини-колец, чтобы предотвратить образование новых мини-колец, вся сеть кДНК будет вращаться вокруг центральной оси диска. Считается, что вращение напрямую связано с репликацией соседнего жгутика, поскольку дочернее базальное тело также будет вращаться вокруг материнского базального тела во времени и способом, аналогичным вращению кинетопласта. Вращаясь, мини-кольца дочернего кинетопласта собираются по спирали и начинают двигаться внутрь к центру диска, поскольку новые мини-кольца разъединяются и перемещаются в KFZ для репликации. [2] [5] [6]
Хотя точные механизмы кДНК максикольца еще предстоит определить так же подробно, как и кДНК миникольца, наблюдается структура, называемая nabelschnur ( по -немецки « пуповина »), которая связывает сети дочерних кДНК, но в конечном итоге рвется во время разделения. С помощью зондов FISH для нацеливания на набельшнура было обнаружено, что он содержит кДНК максикольца. [5]
Репликация кинетопласта описывается как происходящая в пять стадий, каждая из которых связана с репликацией соседнего жгутика.
Trypanosoma cruzi способна восстанавливать нуклеотиды в своей геномной или кинетопластной ДНК , которые были повреждены активными формами кислорода , вырабатываемыми хозяином паразита во время инфекции. [7] ДНК-полимераза бета , экспрессируемая в T. cruzi, используется для устранения окислительных повреждений ДНК в процессе эксцизионной репарации оснований . Похоже, что ДНК-полимераза бета действует во время репликации ДНК кинетопласта , восстанавливая окислительные повреждения ДНК, вызванные генотоксическим стрессом в этой органелле. [7]