
Степень окисления кислорода равна −2 почти во всех известных соединениях кислорода . Степень окисления −1 встречается в нескольких соединениях, таких как пероксиды . Соединения , содержащие кислород в других степенях окисления, встречаются очень редко: − 1 ⁄ 2 ( супероксиды ), − 1 ⁄ 3 ( озониды ), 0 (элементарная, фторноватистая кислота ), + 1 ⁄ 2 ( диоксигенил ), +1 ( диоксидифторид ) и +2 ( дифторид кислорода ).
Кислород является реактивным и образует оксиды со всеми другими элементами, за исключением благородных газов гелия , неона , аргона и криптона . [1]
Вода ( H
2O ) — оксид водорода и наиболее известное соединение кислорода . Его объемные свойства частично являются результатом взаимодействия его составляющих атомов, кислорода и водорода, с атомами соседних молекул воды. Атомы водорода ковалентно связаны с кислородом в молекуле воды, но также имеют дополнительное притяжение (около 23,3 кДж·моль −1 на атом водорода) к соседнему атому кислорода в отдельной молекуле. [2] Эти водородные связи между молекулами воды удерживают их примерно на 15% ближе, чем можно было бы ожидать в простой жидкости только с силами Ван-дер-Ваальса . [3] [4]

Благодаря своей электроотрицательности кислород образует химические связи почти со всеми другими свободными элементами при повышенных температурах, образуя соответствующие оксиды . Однако некоторые элементы, такие как железо , которое окисляется до оксида железа , или ржавчины, Fe
2О
3, легко окисляются при стандартных условиях температуры и давления (СТП). Поверхность металлов, таких как алюминий и титан, окисляются в присутствии воздуха и покрываются тонкой пленкой оксида, которая пассивирует металл и замедляет дальнейшую коррозию . [5] Так называемые благородные металлы, такие как золото и платина , устойчивы к прямому химическому соединению с кислородом, и такие вещества, как оксид золота (III) ( Au
2О
3) должен быть сформирован косвенным путем.
Щелочные металлы и щелочноземельные металлы спонтанно реагируют с кислородом при воздействии сухого воздуха, образуя оксиды, и образуют гидроксиды в присутствии кислорода и воды. В результате ни один из этих элементов не встречается в природе в виде свободного металла. Цезий настолько активен в реакции с кислородом, что его используют в качестве геттера в вакуумных трубках . Хотя твердый магний медленно реагирует с кислородом при СТП, он способен гореть на воздухе, создавая очень высокие температуры, а его металлический порошок может образовывать взрывоопасные смеси с воздухом.
Кислород присутствует в атмосфере в виде соединений в следовых количествах в виде углекислого газа ( CO
2) и оксиды азота (NO x ). Породы земной коры в значительной степени состоят из оксидов кремния ( кремнезема SiO
2, найденный в граните и песке ), алюминий ( оксид алюминия Al
2О
3, в бокситах и корунде ), железо ( оксид железа (III) Fe
2О
3, в гематите и ржавчине ) и другие оксиды металлов .

Остальная часть земной коры также образована кислородными соединениями, наиболее важными из которых являются карбонат кальция (в известняке ) и силикаты (в полевых шпатах ). Водорастворимые силикаты в форме Na
4SiO
4, На
2SiO
3, и На
2Си
2О
5используются как моющие средства и клеи . [6]
Пероксиды сохраняют часть исходной молекулярной структуры кислорода (( − OO − ). Белый или светло-желтый пероксид натрия ( Na
2О
2) образуется при сжигании металлического натрия в кислороде. Каждый атом кислорода в его пероксидном ионе может иметь полный октет из 4 пар электронов . [6] Супероксиды — это класс соединений, которые очень похожи на пероксиды, но только с одним неспаренным электроном на каждую пару атомов кислорода ( O−
2). [6] Эти соединения образуются при окислении щелочных металлов с большими ионными радиусами (K, Rb, Cs). Например, супероксид калия ( KO
2) — оранжево-желтое твердое вещество, образующееся при реакции калия с кислородом.
Перекись водорода ( H
2О
2) можно получить, пропуская через электрический разряд объем водорода, составляющий от 96% до 98%, и кислорода, составляющий от 2 до 4%. [7] Более коммерчески выгодный метод заключается в том, чтобы позволить органическому промежуточному продукту, 2-этилантрагидрохинону, растворенному в органическом растворителе, окислиться до H
2О
2и 2-этилантрахинон. [7] Затем 2-этилантрахинон восстанавливается и возвращается в процесс.
При растворении в воде многие оксиды металлов образуют щелочные растворы, тогда как многие оксиды неметаллов образуют кислотные растворы. Например, оксид натрия в растворе образует сильное основание гидроксид натрия , тогда как пентоксид фосфора в растворе образует фосфорную кислоту . [7]
Кислородсодержащие анионы , такие как хлораты ( ClO−
3), перхлораты ( ClO−
4), хроматы ( CrO2−
4), дихроматы ( Cr
2О2−
7), перманганаты ( MnO−
4) и нитраты ( NO−
3) являются сильными окислителями. Кислород образует гетерополикислоты и полиоксометаллат- ионы с вольфрамом , молибденом и некоторыми другими переходными металлами , например, фосфорновольфрамовую кислоту ( H
3ПВ
12О
40) и октадекамолибдофосфорная кислота ( H
6П
2Мо
18О
62).
Кислород может образовывать оксиды с более тяжелыми благородными газами ксеноном и радоном , хотя для этого нужны косвенные методы. Несмотря на то, что оксиды криптона неизвестны, кислород способен образовывать ковалентные связи с криптоном в нестабильном соединении Kr(OTeF 5 ) 2 .
Одним из неожиданных соединений кислорода является диоксигенилгексафтороплатинат , O+
2ПТФ−
6, обнаруженный при изучении свойств гексафторида платины ( PtF
6). [8] Изменение цвета при воздействии на это соединение атмосферного воздуха предполагало, что происходит окисление дикислорода (в свою очередь, сложность окисления кислорода привела к гипотезе о том, что ксенон может окисляться PtF
6, что привело к открытию первого соединения ксенона гексафтороплатината ксенона Xe+
ПТФ−
6). Катионы кислорода образуются только в присутствии более сильных окислителей, чем кислород, что ограничивает их действие фтором и некоторыми фтористыми соединениями. Известны простые фториды кислорода . [9]
Среди наиболее важных классов органических соединений, содержащих кислород, находятся (где «R» — органическая группа): спирты (R-OH); простые эфиры (ROR); кетоны (R-CO-R); альдегиды (R-CO-H); карбоновые кислоты (R-COOH); сложные эфиры (R-COO-R); ангидриды кислот (R-CO-O-CO-R); амиды (RC(O)-NR 2 ). Существует много важных органических растворителей , содержащих кислород, среди которых: ацетон , метанол , этанол , изопропанол , фуран , ТГФ , диэтиловый эфир , диоксан , этилацетат , ДМФА , ДМСО , уксусная кислота , муравьиная кислота . Ацетон ( (CH
3)
2CO ) и фенол ( C
6ЧАС
5OH ) используются в качестве исходных материалов в синтезе множества различных веществ. Другими важными органическими соединениями, содержащими кислород, являются: глицерин , формальдегид , глутаровый альдегид , лимонная кислота , уксусный ангидрид , ацетамид и т. д. Эпоксиды — это простые эфиры , в которых атом кислорода является частью кольца из трех атомов.
Кислород спонтанно реагирует со многими органическими соединениями при комнатной температуре или ниже в процессе, называемом автоокислением . [7] Щелочные растворы пирогаллола , бензол-1,2,3-триола поглощают кислород из воздуха и используются для определения концентрации кислорода в атмосфере. Большинство органических соединений , содержащих кислород, не производятся прямым действием кислорода. Органические соединения, важные в промышленности и торговле, производятся прямым окислением прекурсора, включая: [6]
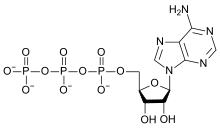
Этот элемент содержится почти во всех биомолекулах , которые важны для жизни или генерируются ею. Только несколько распространенных сложных биомолекул, таких как сквален и каротины , не содержат кислорода. Из органических соединений, имеющих биологическое значение, углеводы содержат наибольшую долю кислорода по массе (около 50%). Все жиры , жирные кислоты , аминокислоты и белки содержат кислород (из-за наличия карбонильных групп в этих кислотах и их эфирных остатках). Кроме того, семь аминокислот, которые включены в белки, также имеют кислород, включенный в их боковые цепи. Кислород также встречается в фосфатных (PO 4 3− ) группах в биологически важных молекулах-переносчиках энергии АТФ и АДФ , в основной цепи и пуринах (кроме аденина ) и пиримидинах РНК и ДНК , а также в костях в виде фосфата кальция и гидроксиапатита .